奥赛康药业抗CLDN18.2单抗ASKB589启动关键3期临床,一线治疗胃癌
近日,中国药物临床试验登记与信息公示平台官网公示,奥赛康药业已经启动CLDN18.2单抗ASKB589注射液的3期临床研究,针对适应症为一线治疗不可切除的局部晚期、复发性或转移性胃及食管胃交界处腺癌。
ASKB589为奥赛康自主研发的、拥有自主知识产权的生物创新药,是靶向CLDN18.2的重组人源化单克隆抗体药物。该药物主要通过高亲和力加强介导抗体依赖的细胞介导的细胞毒性作用(ADCC)和补体依赖的细胞毒作用(CDC)。临床前研究结果显示ASKB589对CLDN18.2的亲和力和特异性高,且均转化为更强的抗体依赖细胞介导 (ADCC) 和补体依赖的细胞毒性作用 (CDC)。公司已于2022年完成了ASKB589于实体瘤受试者临床试验单药和联合CAPOX化疗方案的剂量递增阶段的病人入组。2023年10月16日,奥赛康药业发布公告,称其子公司AskGene自主开发的生物创新药ASKB589注射液获CDE批准在中国开展III期关键性临床试验。
此前, ASKB589用于实体瘤患者的I/II期试验多中心试验最新研究成果,在第十五届国际胃癌大会(IGCC)上由北京大学肿瘤医院沈琳教授以口头汇报形式公布。该试验旨在评估ASKB589单药和联合化疗治疗的安全性及耐受性、药代动力学、免疫原性和初步疗效,包括ASKB589单药剂量递增和扩展研究(Part A)及ASKB589联合化疗剂量递增和扩展研究(Part B)。剂量递增研究的患者不受CLDN18.2表达情况的限制,剂量扩展研究仅入组经中心实验室评估为CLDN18.2阳性的患者。试验结果显示,在24例接受≥6mg/kg剂量的患者中,经研究者确认的客观缓解率(cORR)为79.2%,疾病控制率(DCR)达95.8%;在13例接受6mg/kg剂量的患者中,ORR为84.6%,DCR为92.3%;在11例接受10mg/kg剂量的患者中,ORR为72.7%,DCR为100%。
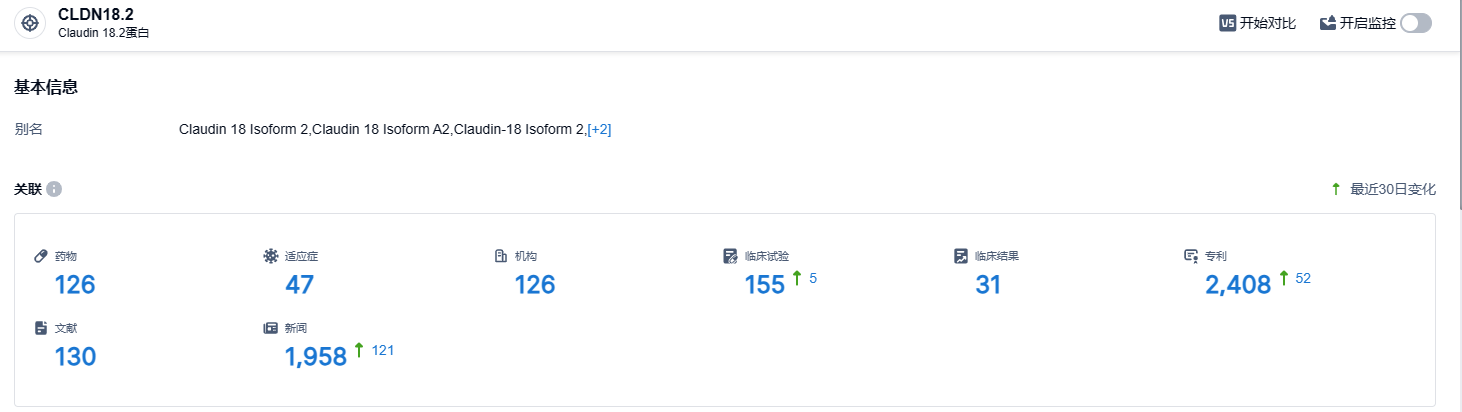
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 CLDN18.2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年11月29日,CLDN18.2 靶点共有在研药物126个,包含的适应症有47种,在研机构126家,涉及相关的临床试验155件,专利多达2408件……CLDN18.2靶点研发热度非常高,在国内外均有不少药企研发,期待国产CLDN18.2靶点新药能够尽早上市,与外企新药同台竞技。