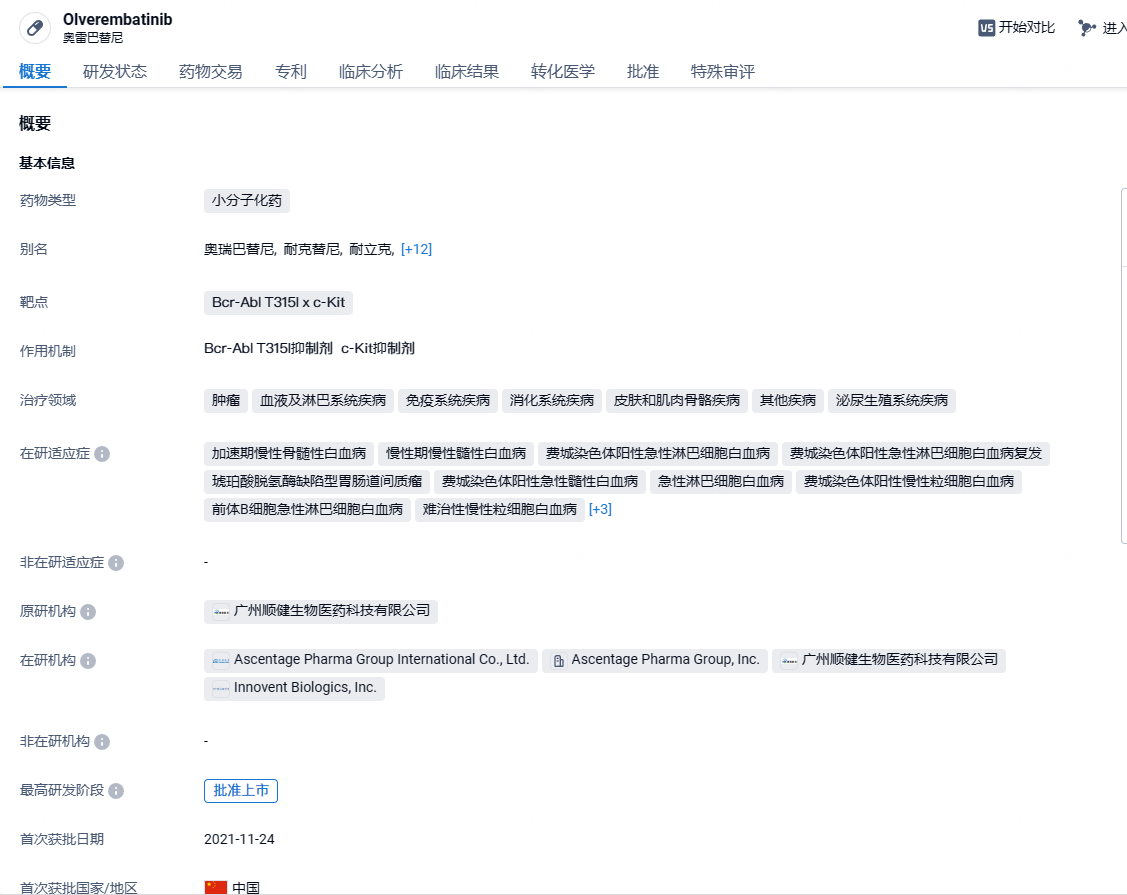
亚盛医药BCR-ABL抑制剂奥雷巴替尼在中国澳门获批上市,治疗慢性髓细胞白血病
2024年7 月 8 日,亚盛医药宣布,公司原创 1 类新药奥雷巴替尼(商品名:耐立克)正式获中国澳门特别行政区药物监督管理局(ISAF)批准上市。本次获批的适应症包括:治疗任何酪氨酸激酶抑制剂(TKI)耐药、并伴有 T315I 突变的慢性髓细胞白血病(CML)慢性期(-CP)和加速期(-AP)的成年患者;以及治疗对一代和二代 TKI 耐药和/或不耐受的 CML-CP 成年患者。
奥雷巴替尼是首个由中国本土企业研发的第三代Bcr-Abl T315I抑制剂,也是亚盛医药创立十余年来首款获批的创新药。2021年11月奥雷巴替尼获国家药品监督管理局药品审评中心批准上市,用于治疗任何TKI耐药、并伴有T315I突变的慢性髓细胞白血病(CML)慢性期(-CP)或加速期(-AP)成年患者。此前,该药物已获《CSCO恶性血液病诊疗指南》推荐,用于治疗Ph+ALL患者。奥雷巴替尼最初由中国科学院广州生物医药与健康研究院研发合成。2013 年 6 月,顺健生物医药与研究院签订了技术转让协议。2016 年 12 月,亚盛医药成功收购顺健生物医药。2021 年 7 月,亚盛医药宣布与信达生物合作,共同开发和推广奥雷巴替尼。
2023 ASH 年会上公布的多中心、随机、注册性 II 期研究评估了奥雷巴替尼与最佳可用治疗(BAT)相比,在对三种 TKI 耐药和/或不耐受的 CML-CP 患者中的疗效和安全性。结果显示,奥雷巴替尼组的 mEFS 为 21.22 个月,BAT 组为 2.86 个月。奥雷巴替尼组预计 24 个月和 36 个月的 EFS 分别为 46.9% 和 47%。BAT 组预计 24 个月的 EFS 为 16.9%。在 ITT 效力分析人群中,接受奥雷巴替尼治疗的患者有 85% 达到 CHR,47.7% 达到 MCyR,36.4% 达到 CCyR,27.3% 达到 MMR。BAT 组中,相应比例分别为 34.8%、29.7%、16.2% 以及 8.1%。
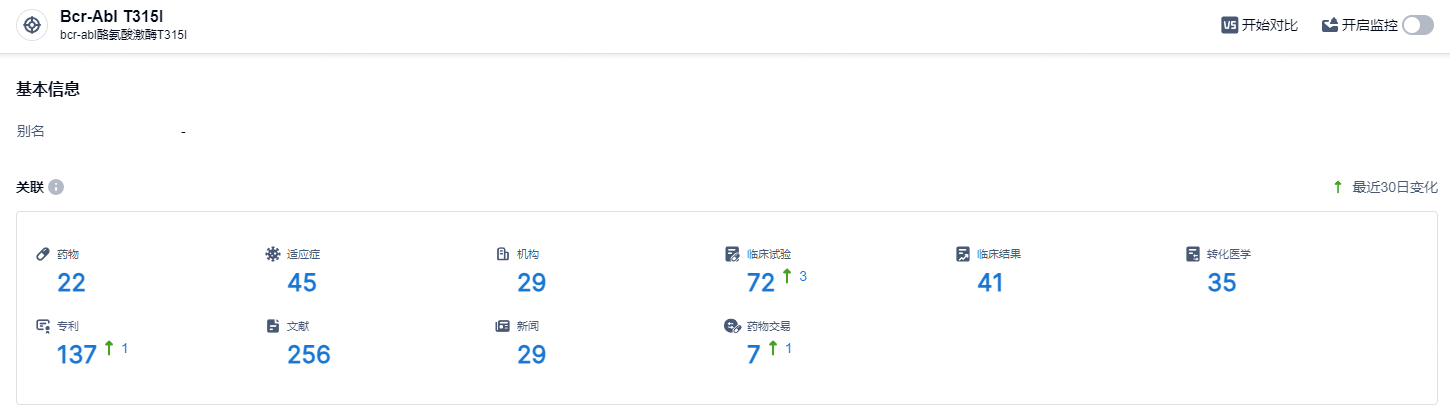
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达Bcr-Abl T315I靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年7月9日,Bcr-Abl T315I靶点共有在研药物22个,包含的适应症有45种,在研机构29家,涉及相关的临床试验72件,专利多达137件……作为中国首个获批上市的三代BCR-ABL抑制剂,奥雷巴替尼不仅改变了国内包括T315I突变CML患者无药可医的现状,也逐步满足着其他耐药CML和Ph+ ALL患者未被满足的临床需求。在最新版《CSCO指南》中,奥雷巴替尼获得众多I级推荐,充分证明了奥雷巴替尼的临床价值和临床潜力。期待奥雷巴替尼后续研究能够顺利,为国内带来新的治疗选择。