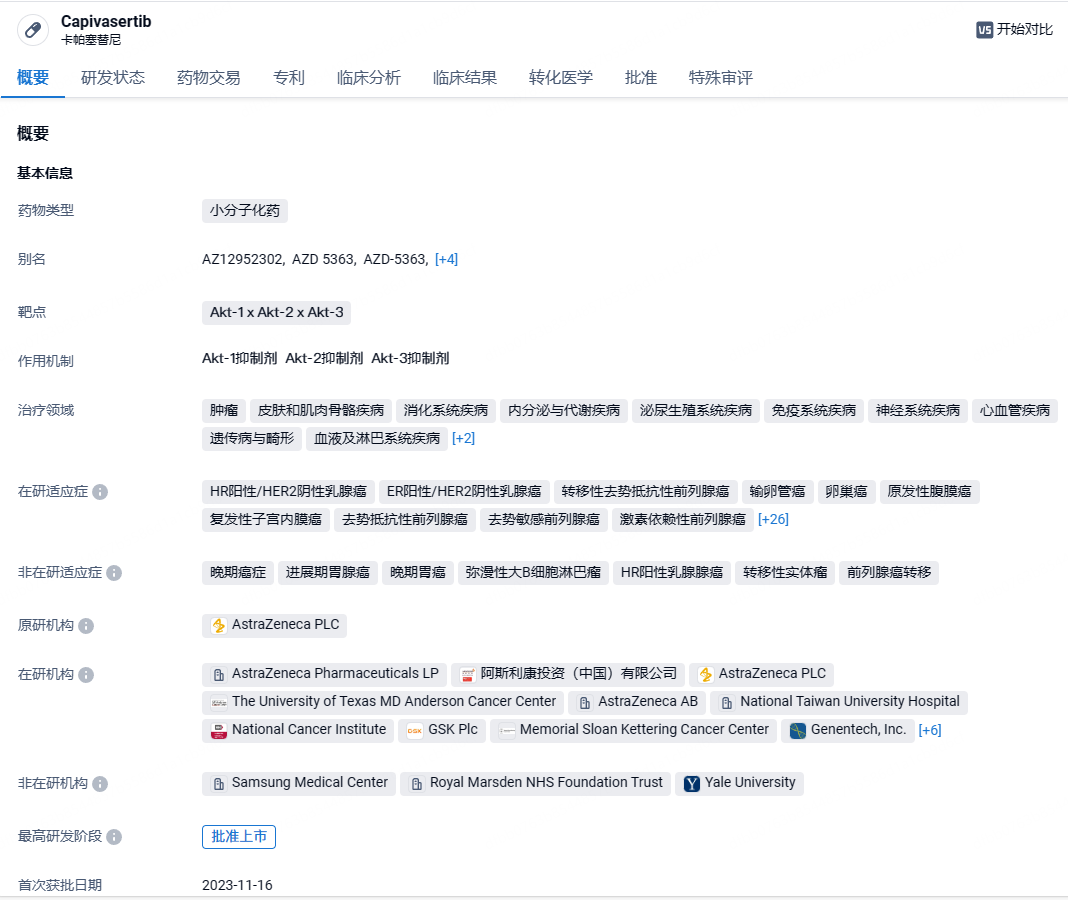
阿斯利康首创AKT抑制剂capivasertib在欧盟获批上市,针对乳腺癌
2024年6月20日,阿斯利康AKT抑制剂capivasertib已在欧盟获批,与氟维司群联合用于治疗雌激素受体阳性(ER+)、人表皮生长因子受体2阴性(HER2-)、伴有一种或多种PIK3CA、AKT1或PTEN基因突变的局部晚期或转移性乳腺癌成年患者,这些患者在使用基于内分泌的治疗方案后复发或病情进展。
Capivasertib是一种新型、高效、选择性 ATP 竞争性泛 Akt激酶抑制剂,在三种亚型 AKT1、AKT2 和 AKT3 中具有相似的活性。此药品在2023年1月获FDA授予快速通道资格。Capivasertib在早期试验中的结果便展现出不俗潜力,无论患者的 PIK3CA/AKT1/PTEN 突变状态如何,均可获得临床获益。氟维司群是一种雌激素受体拮抗剂、内分泌疗法。两者的联合疗法在临床试验中展现出对乳腺癌患者优秀的治疗效果。2023年11月,capivasertib获FDA批准上市,用于治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者,这些患者在接受内分泌基础方案治疗过程中或之后疾病复发或进展。2023年10月10日,CDE官网显示,阿斯利康AKT抑制剂Capivasertib上市申请获得受理。根据临床试验进展,适应症为联合Faslodex(氟维司群)治疗激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)局部晚期或转移性乳腺癌患者,这些患者在接受内分泌基础方案治疗过程中或之后疾病复发或进展。
欧盟委员会是根据《新英格兰医学杂志》上发表的III期CAPItello-291试验结果批准该药物的。在该试验中,capivasertib联合氟维司群与氟维司群联合安慰剂相比,可将携带PI3K、AKT或PTEN突变的肿瘤患者的疾病进展或死亡风险降低50%(HR=0.50, 95% CI, 0.38-0.65; p<0.001;中位无进展生存期(PFS)分别为7.3个月 vs 3.1个月)。在欧洲,乳腺癌仍然是癌症死亡的主要原因,2022年有14万多人死亡,同年确诊患者超过55万人。激素受体(HR)阳性乳腺癌(表达雌激素或孕激素受体,或两者都表达)是最常见的乳腺癌亚型,70%的肿瘤中表现出HR阳性和HER2阴性。超过97%的HR阳性乳腺癌中ER表达也是阳性。总的来说,PIK3CA、AKT1和PTEN的突变经常发生,影响大约50%的晚期HR阳性乳腺癌患者。在CAPItello-291试验中,capivasertib联合氟维司群的安全性与之前评估该组合的试验中观察到的安全性相似。
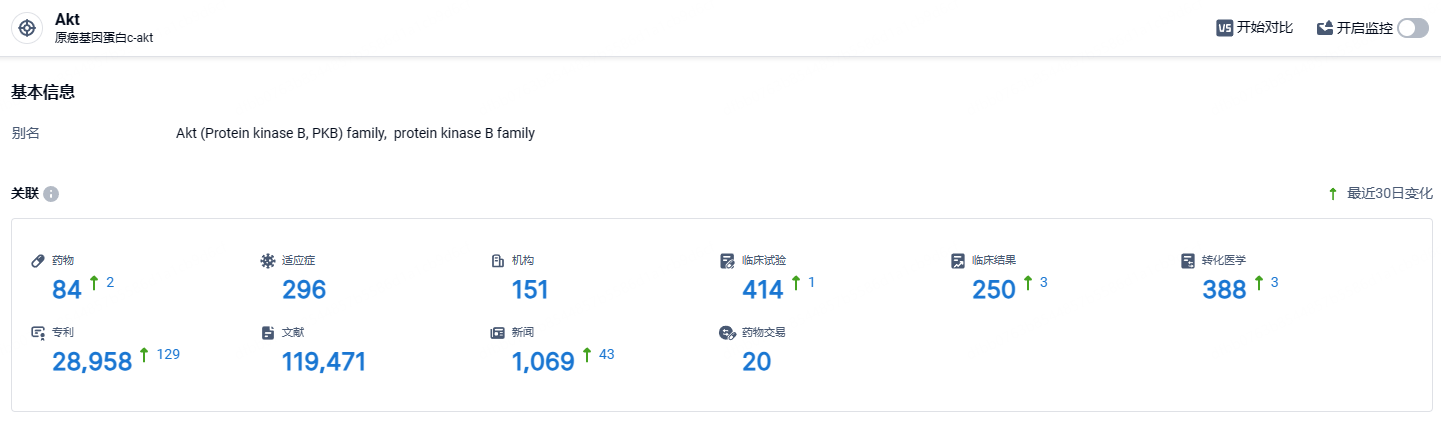
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 Akt靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月21日,Akt靶点共有在研药物84个,包含的适应症有296种,在研机构151家,涉及相关的临床试验414件,专利多达28958件……目前,capivasertib还在与既有疗法联合治疗乳腺癌(CAPItello-292)和前列腺癌(CAPItello-280 和 CAPItello-281)的III期试验中接受评估。期待这款首创的AKT抑制剂有望给多个癌种患者带来新的治疗选择。