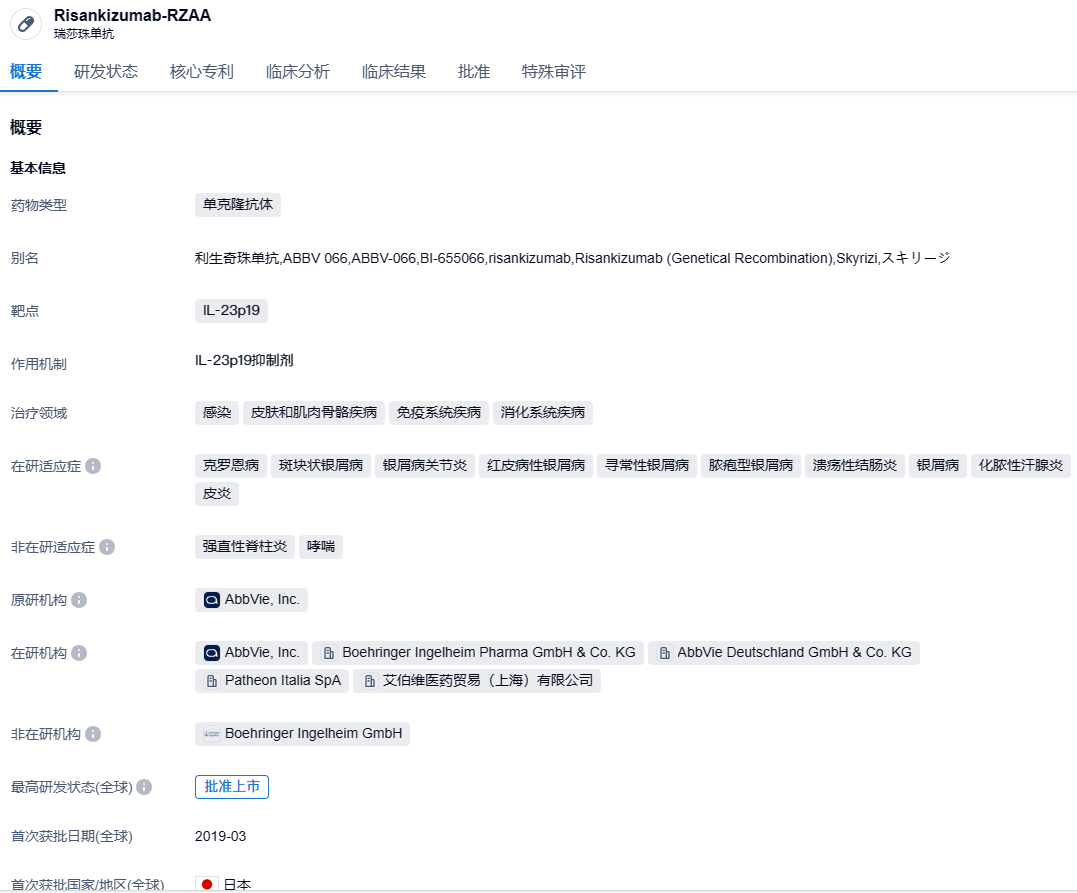
艾伯维重磅IL-23抑制剂risankizumab再获FDA批准,治疗溃疡性结肠炎
2024年6月19日,艾伯维(AbbVie)宣布,美国FDA已批准Skyrizi(risankizumab)扩展适应症,用于治疗中度至重度活动性溃疡性结肠炎成人患者。这一批准使其成为首个被批准用于治疗中重度溃疡性结肠炎和中重度克罗恩病的IL-23特异性抑制剂。Skyrizi目前已被批准用于治疗四种免疫介导的炎症性疾病。
Risankizumab是一种白细胞介素-23(IL-23)抑制剂,通过与其p19亚基结合选择性阻断IL-23。IL-23是一种参与炎症过程的细胞因子,被认为与许多慢性免疫介导的疾病有关。Risankizumab首次获批时间为2019年4月,已获FDA和EMA批准的两项适应症分别为银屑病性关节炎和斑块状银屑病。Skyrizi上市首年大卖3.55亿美元,第二年销量达到15.9亿美元,2022全球销售额已经达到51.65亿美元。此外,Risankizumab还有多项自身免疫疾病相关适应症的研发进度正在积极推动中。2023年7月6日,艾伯维利生奇珠单抗(risankizumab)注射液及其皮下注射剂型国内上市申请获国家药监局药审中心受理。2023年8月29日,艾伯维(AbbVie)已向美国FDA和欧洲EMA递交Skyrizi(Risankizumab)治疗中度至重度溃疡性结肠炎(UC)成人患者的新适应症申请。
此前发布的3期临床试验结果显示,接受180 mg、360 mg risankizumab治疗的患者中,有显著更高比例在52周时达到临床缓解:分别为40%和38%,此数值在对照组中为25%(p<0.01)。
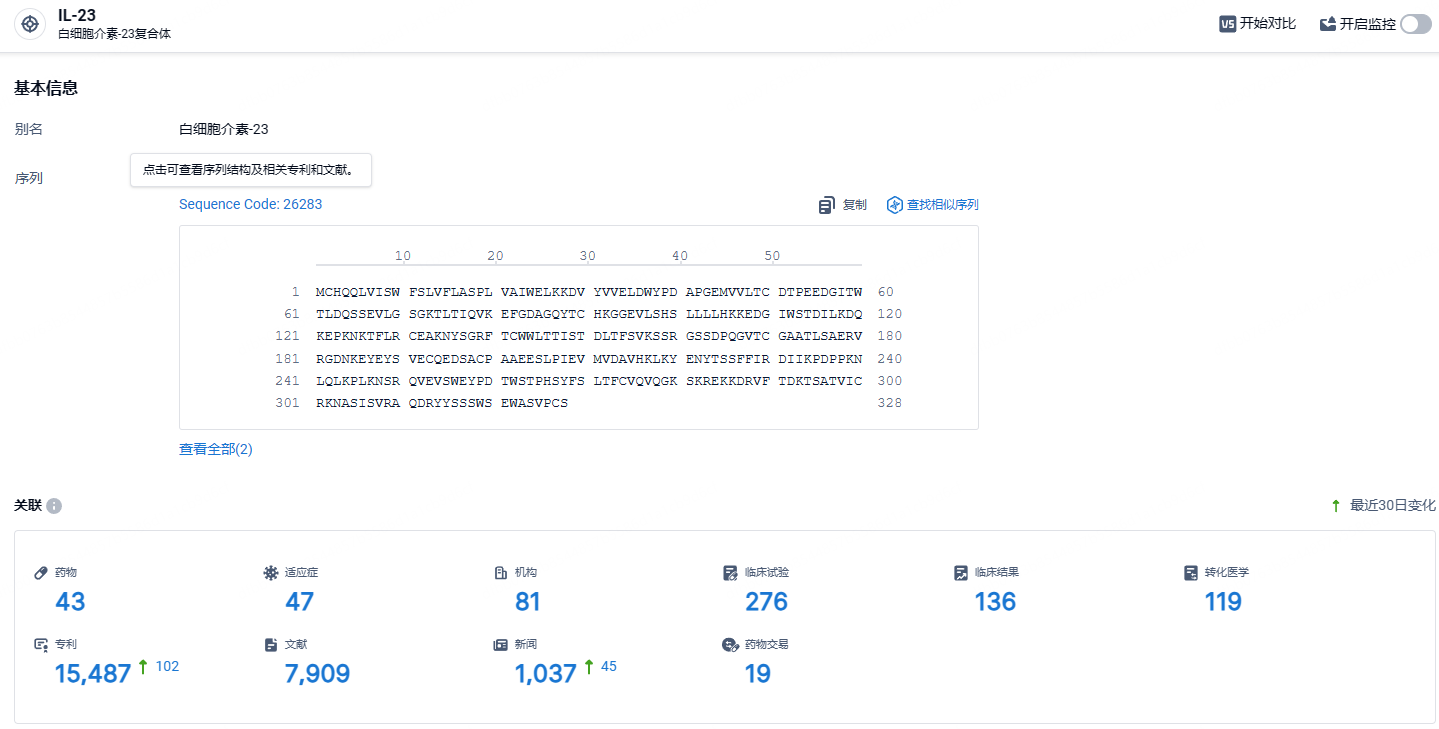
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 IL-23 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月20日,IL-23 靶点共有在研药物43个,包含的适应症有47种,在研机构81家,涉及相关的临床试验276件,专利多达15487件……Risankizumab自2019年上市以来,销售持续保持高速增长的态势,全球三大药物市场,唯独还未在中国获批上市,相信未来进入中国市场后,将会创造新的销售奇迹。