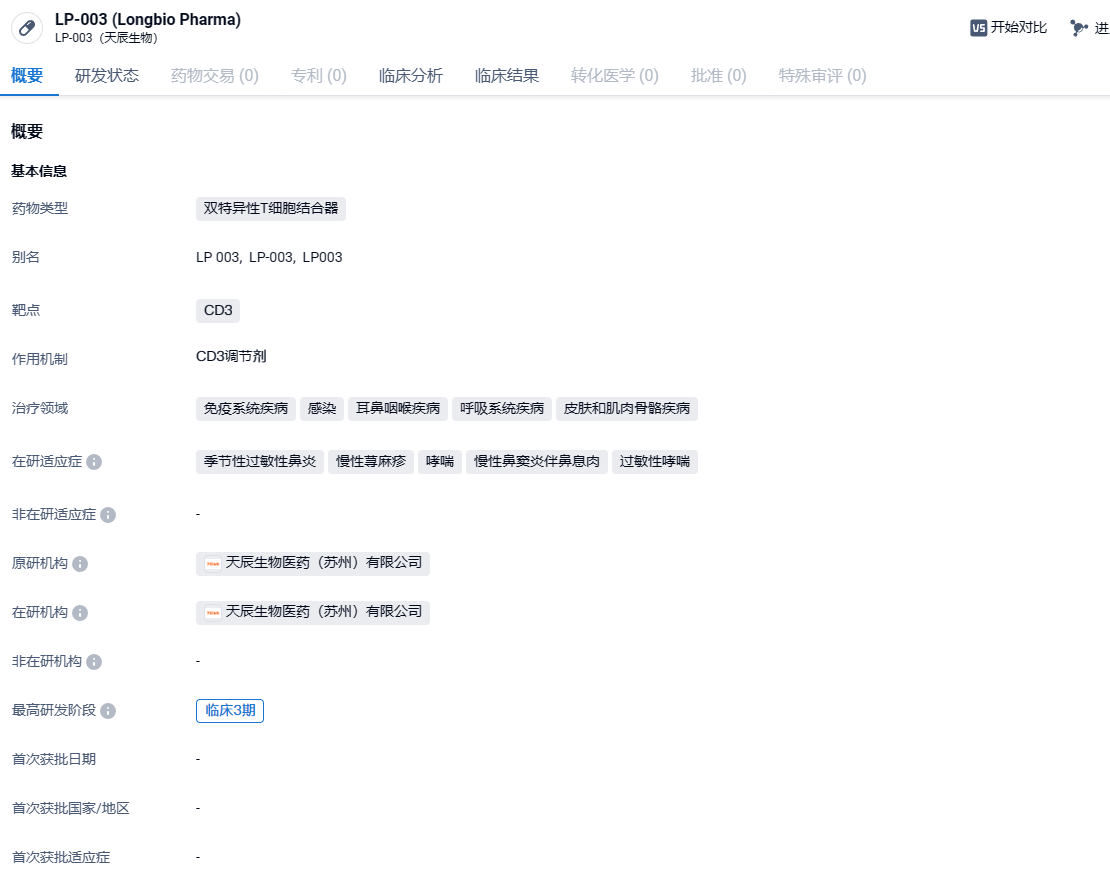
天辰生物抗IgE抗体LP-003注射液启动3期临床,针对过敏性鼻炎
近日,中国药物临床试验登记与信息公示平台公示,天辰生物已经启动一项评价LP-003注射液治疗季节性过敏性鼻炎患者的3期临床试验,该研究拟在中国29家临床研究中心入组540名受试者。LP-003注射液为新一代抗IgE抗体,此前已经在治疗季节性过敏性鼻炎的2期临床研究中取得积极结果。此外,该产品具有用量低、超长效等特点,在研究中为皮下给药每4周一次(Q4W)。
LP-003为天辰生物自主研发的新一代抗IgE抗体药物,创始人孙乃超博士是全球第一个成功上市的抗IgE抗体药物为奥马珠单抗的主要发明人。LP-003具有高生物学活性,高亲和力,和较长的半衰期,可以在保证有效性/疗效的基础上,覆盖完整的过敏季,同时降低剂量和不良反应,大幅度提高患者的依从性,具有较强的差异化和竞争优势。
II 期临床是一项随机、双盲、安慰剂对照研究,180名患有中重度季节性AR的成年受试者,随机接受LP-003 100mg (n=40)、LP-003 200mg (n=80)或安慰剂(n=60)。主要终点为花粉高峰期鼻症状平均评分(PPP);次要终点包括平均眼部症状评分、免疫原性和安全性等。
结果显示:LP-003组在PPP过程中鼻症状平均评分(TNSS) (100mg组为3.17±2.17,全组为3.45±2.45)显著低于安慰剂组(4.25±2.74),P值均<0.05。
同时,LP-003表现出良好的安全性,与安慰剂组的不良事件发生率相似。最常见的不良反应(两组均>2%)为高尿酸血症、上呼吸道感染和鼻咽炎。
与第一代抗IgE抗体奥马珠单抗(omalizumab)相比,100mg LP-003在本研究中表现出与300mg omalizumab相当的疗效;此外,亚组分析显示,在类似花粉密度条件下,LP-003与omalizumab相比具有潜在的生物活性优势。
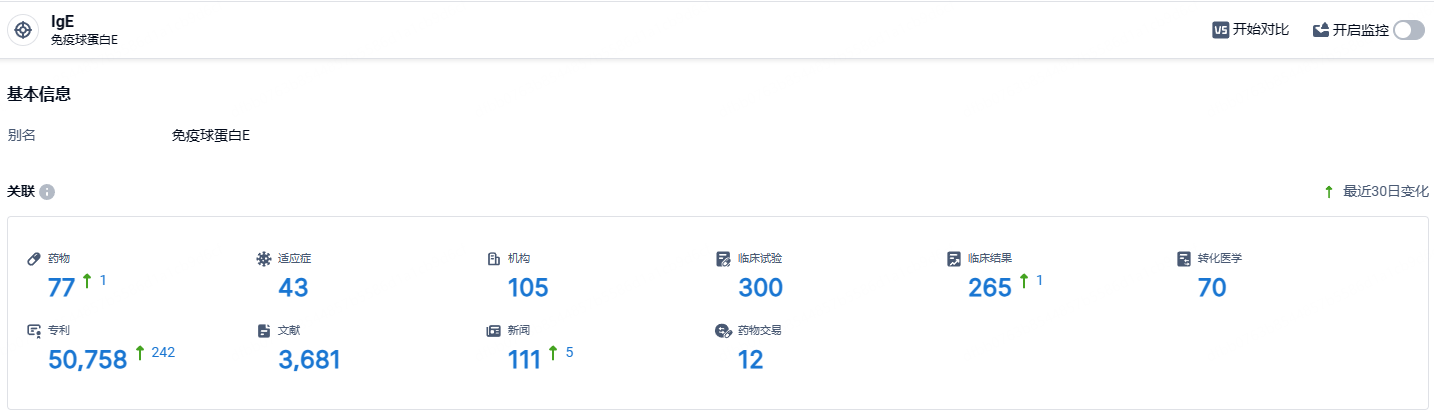
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IgE 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月20日,IgE靶点共有在研药物77个,包含的适应症有43种,在研机构105家,涉及相关的临床试验300件,专利多达50758件……抗IgE 单抗研发难度大、技术壁垒高,目前全球同靶点药物研发仅20余家。其中,诺华、罗氏为应对奥马珠单抗专利到期挑战分别开发了IgE 抗体药物ligelizumab和quilizumab,但在与奥马珠单抗头对头临床试验中并未显现明显优越性;在国内,除天辰生物外,联合生物、中天生物/利奥制药的管线均已进入II 期临床。