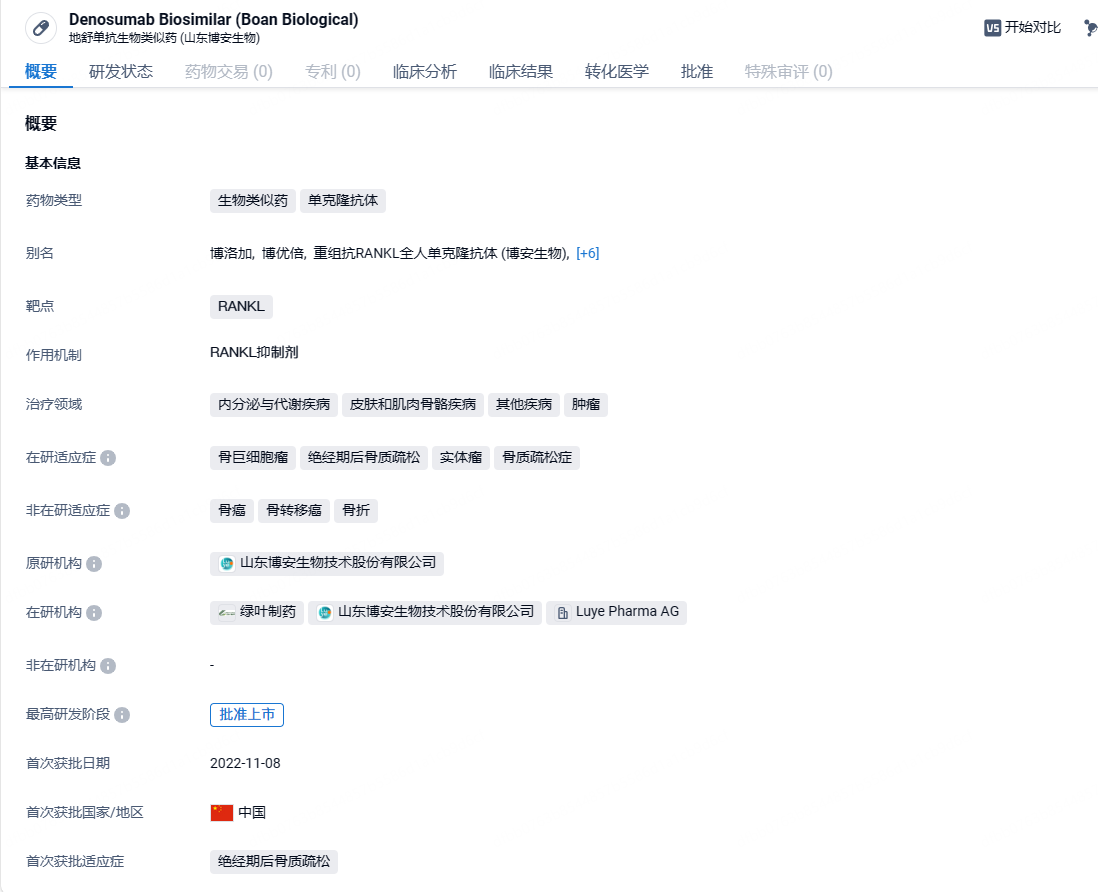
博安生物RANKL单抗地舒单抗生物类似药获批上市,针对骨巨细胞瘤
2024年5月27日,博安生物宣布,其自主开发的肿瘤领域地舒单抗注射液(120mg)——博洛加正式获得中国国家药监局(NMPA)的上市批准,用于治疗不可手术切除或者手术切除可能导致严重功能障碍的骨巨细胞瘤,包括成人和骨骼发育成熟(定义为至少1处成熟长骨且体重≥45 kg)的青少年患者。这是国内第三款上市的地舒单抗生物类似药。
地舒单抗原研公司是安进,作为首个全人源化RANKL抑制剂,可以强效抑制RANKL/RANK/OPG通路,以高特异性和高亲和力与RANKL结合,阻止RANKL与其受体RANK结合,抑制破骨细胞的生成与功能,从而减少骨吸收、增加骨量、改善骨强度,治疗骨质疏松。独特的药代动力学和药效学特性支持半年一次给药方案,给药后可快速抑制骨转换指标,持续减少骨吸收,使用便捷持续有效;精准的药理机制使得地舒单抗作用于100%的骨骼,且无骨基质沉积问题,可以长期使用,有研究表明,地舒单抗可以连续使用十年以上,且具有良好的安全性。博洛加(BA1102)是博安生物第三款向国家药监局获批上市的生物药,此前两款产品博优诺®和博优倍®已经顺利实现了获批上市和商业化。
BA1102遵循生物类似药相关研究指南,通过药学、非临床、人体药代动力学、临床有效性一系列逐步递进的研究,科学、严谨、完整地确证了BA1102与原研参照药的整体相似性,二者的质量、安全性和有效性高度相似,无临床意义上的差异。BA1102与原研参照药对照的两项关键临床研究均达到所有研究终点:1.在健康受试者中的药代动力学(PK)、药效动力学(PD)、安全性、耐受性及免疫原性比对研究,证明了BA1102与原研药PK、PD生物等效;2.在实体瘤骨转移患者中的有效性和安全性比对研究,证明了BA1102与原研药临床有效性、安全性及免疫原性高度相似。
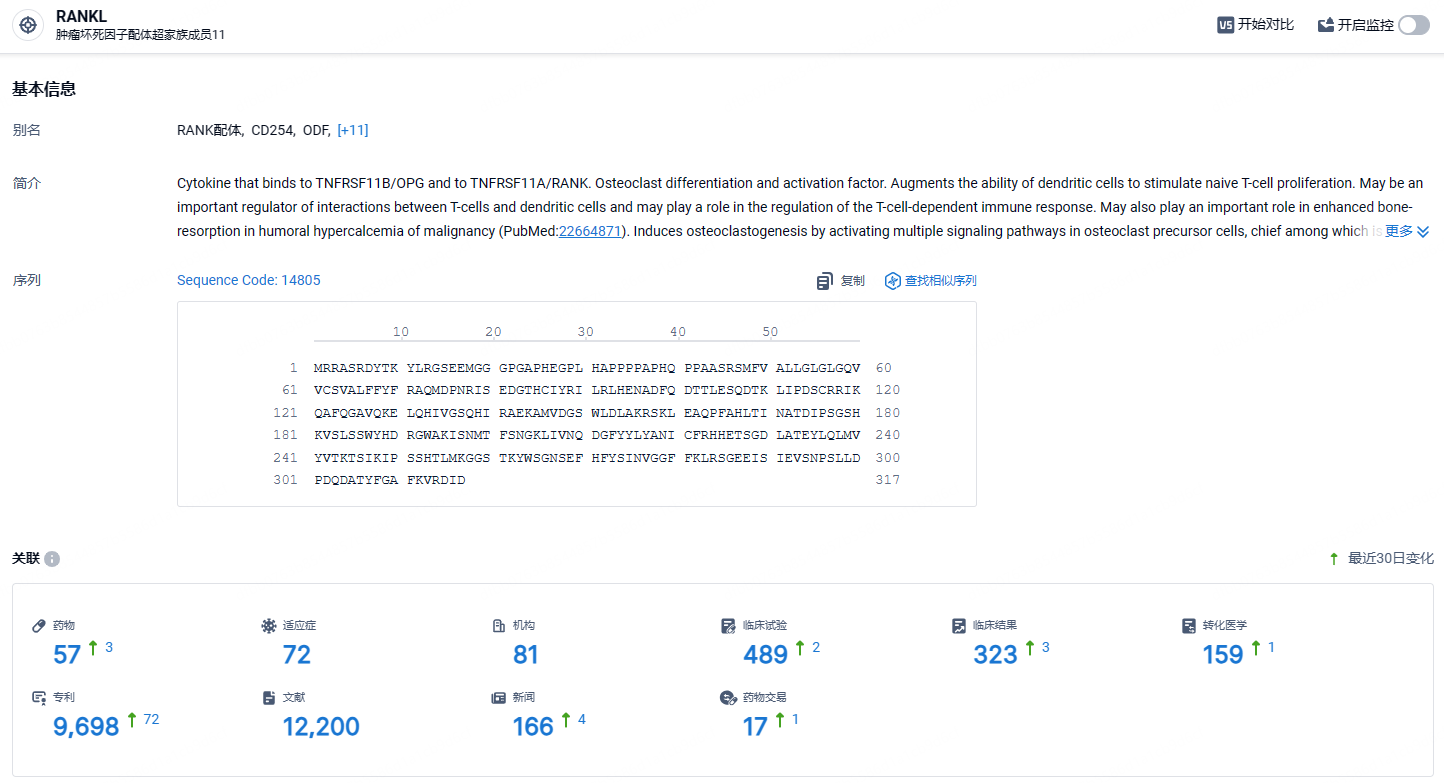
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 RANKL 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年5月28日,RANKL 靶点共有在研药物57个,包含的适应症有72种,在研机构81家,涉及相关的临床试验489件,专利多达9698件……根据安进公司2023年年报显示,地舒单抗2023年实现全球市场销售收入61.60亿美元。此次博洛加成功上市,市场前景广阔。