第一三共/阿斯利康TROP2 ADC Dato-DXd两项上市申请获欧盟受理
2024年3月4日,阿斯利康宣布,EMA已经受理TROP2 ADC Datopotamab deruxtecan(Dato-DXd)两项上市许可申请(MAAs),适应症分别为既往接受过全身治疗的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)成人患者,以及既往接受过至少一种全身治疗的不可切除或转移性HR阳性、HER2低表达或阴性(IHC 0、IHC 1+或IHC 2+/ISH-)乳腺癌成人患者,这些患者疾病已经进展并且不适合内分泌治疗。
Datopotamab deruxtecan(Dato-DXd)是一种由人源化、靶向Trop2的单克隆抗体与创新DNA拓扑异构酶I抑制剂(DXd)连接的ADC。DXd具有独特的作用机制,与常见化疗药物伊立替康(irinotecan)相比,活性提高10倍。而且此药物具有很强渗透细胞膜的能力,让它们在杀伤吞入ADC的癌细胞之后,能够杀死附近的癌细胞,产生“旁观者效应”(bystandereffect)。目前该药物多个适应症处于临床三期,用于治疗肺癌、三阴性乳腺癌和乳腺癌等。2024年2月19日,第一三共/阿斯利康联合宣布,TROP2 ADC Datopotamab deruxtecan(Dato-DXd)的生物制品许可申请(BLA)获FDA受理,适应症为既往接受过全身治疗的局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)成人患者。PDUFA日期为2024年第四季度。如果获得批准,Dato-DXd将成为全球首个治疗肺癌的TROP ADC。
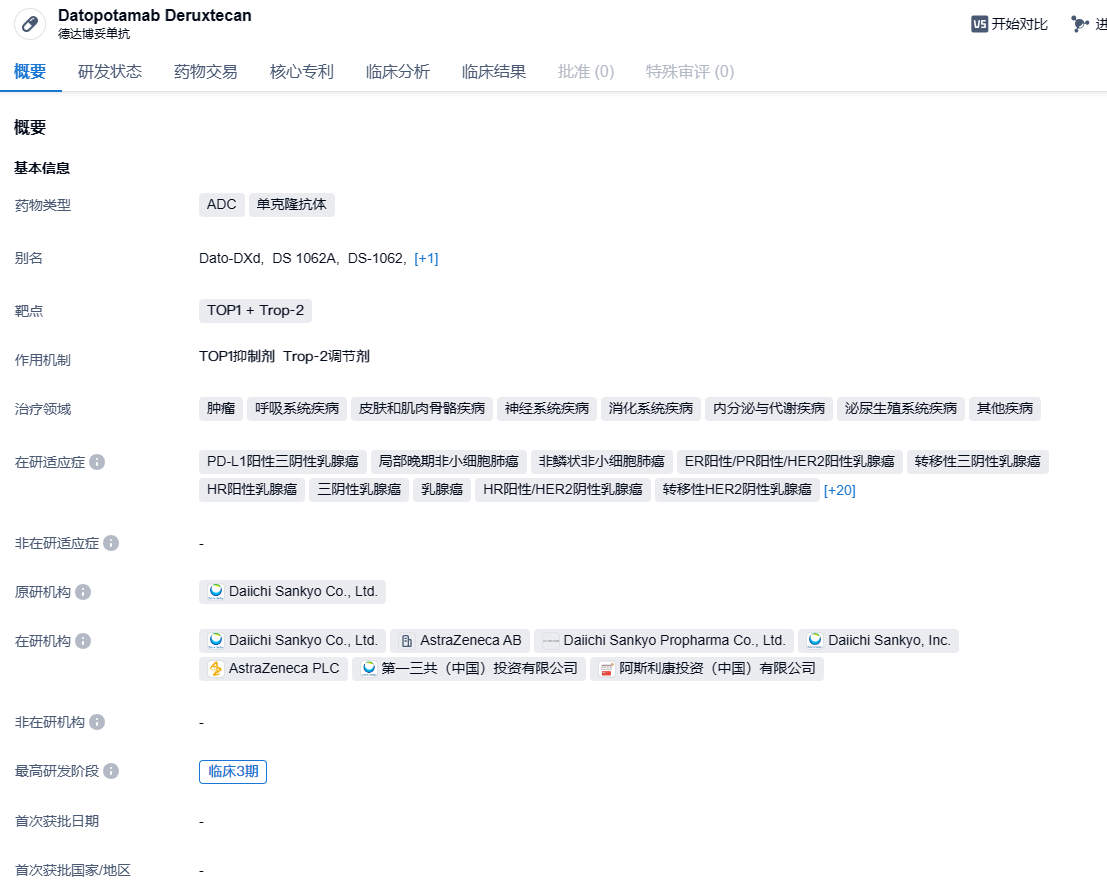 本次上市申请是基于关键III期TROPION-Lung01研究以及TROPION-Breast01研究的积极数据。
本次上市申请是基于关键III期TROPION-Lung01研究以及TROPION-Breast01研究的积极数据。
TROPION-Lung01研究结果显示,与当前标准治疗多西他赛相比,Dato-DXd在主要终点之一无进展生存期(PFS)方面,展现出具有统计学显著性和临床意义的改善。该研究的另一个主要终点总生存期(OS)数据尚不成熟,尽管观察到Dato-DXd相较于多西他赛有利的早期趋势,但未达到中期分析具有统计学意义的预先设定的阈值。目前该试验仍在进行中,以评估更成熟的OS数据。Dato-DXd的安全性与既往研究一致,没有发现新的安全性信号。所有级别的间质性肺病(ILD)总体上与先前的临床试验一致,大多数都是低等级事件。在试验中观察到一些5级事件。
TROPION-Breast01研究结果显示,与对照组相比,Dato-DXd组患者的PFS延长时间具有统计学意义和临床意义。另一主要终点OS的数据尚不成熟,该试验将按计划继续进行以评估OS。此外,Dato-DXd的安全性与既往研究一致,没有发现新的安全信号。所有级别的间质性肺疾病发病率均较低。
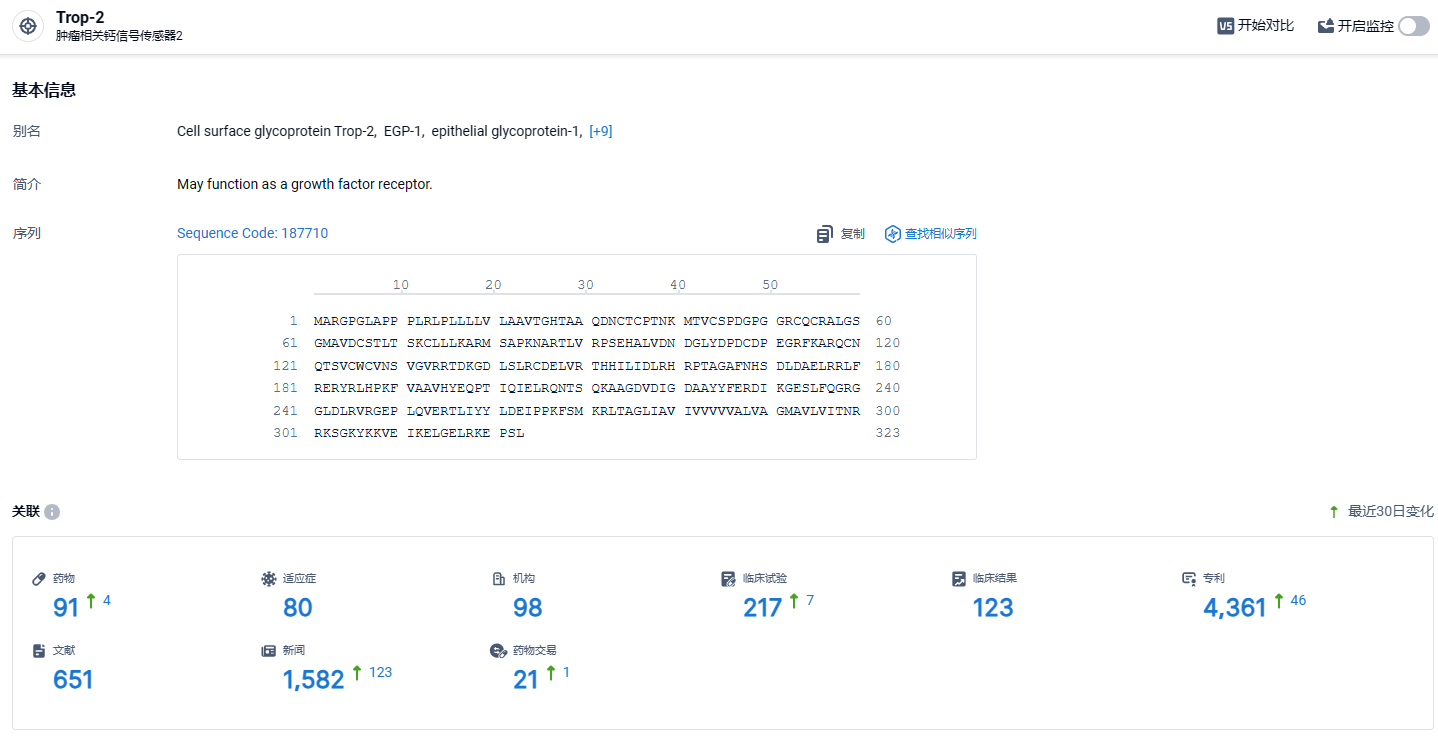
根据智慧芽新药情报库所披露的信息(点击下方图片直达Trop2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年3月5日,Trop2靶点共有在研药物91个,包含的适应症有80种,在研机构98家,涉及相关的临床试验217件,专利多达4361件……TROP2在很多实体瘤中呈高表达,且TROP2的过表达往往与不良预后和转移风险增加相关。在基因水平上,TROP2在尿路上皮癌、乳腺癌、宫颈癌、结直肠癌、肺癌、卵巢癌、胰腺癌、甲状腺癌、子宫内膜癌等均呈高表达。Dato-DXd临床数据优秀,市场潜力不俗。