GSK抗PD-1单抗Dostarlimab在中国再获批2项临床,针对结肠癌、头颈癌
近日,中国国家药监局药品审评中心(CDE)官网公示葛兰素史克(GSK)申报的dostarlimab注射液在中国获得两项新的临床试验默示许可,拟用于局部晚期错配修复功能缺陷型(dMMR)/高度微卫星不稳定性(MSI-H)的成人结肠癌患者的围手术期治疗;局部晚期未切除头颈部鳞状细胞癌成人患者放化疗后的序贯治疗。
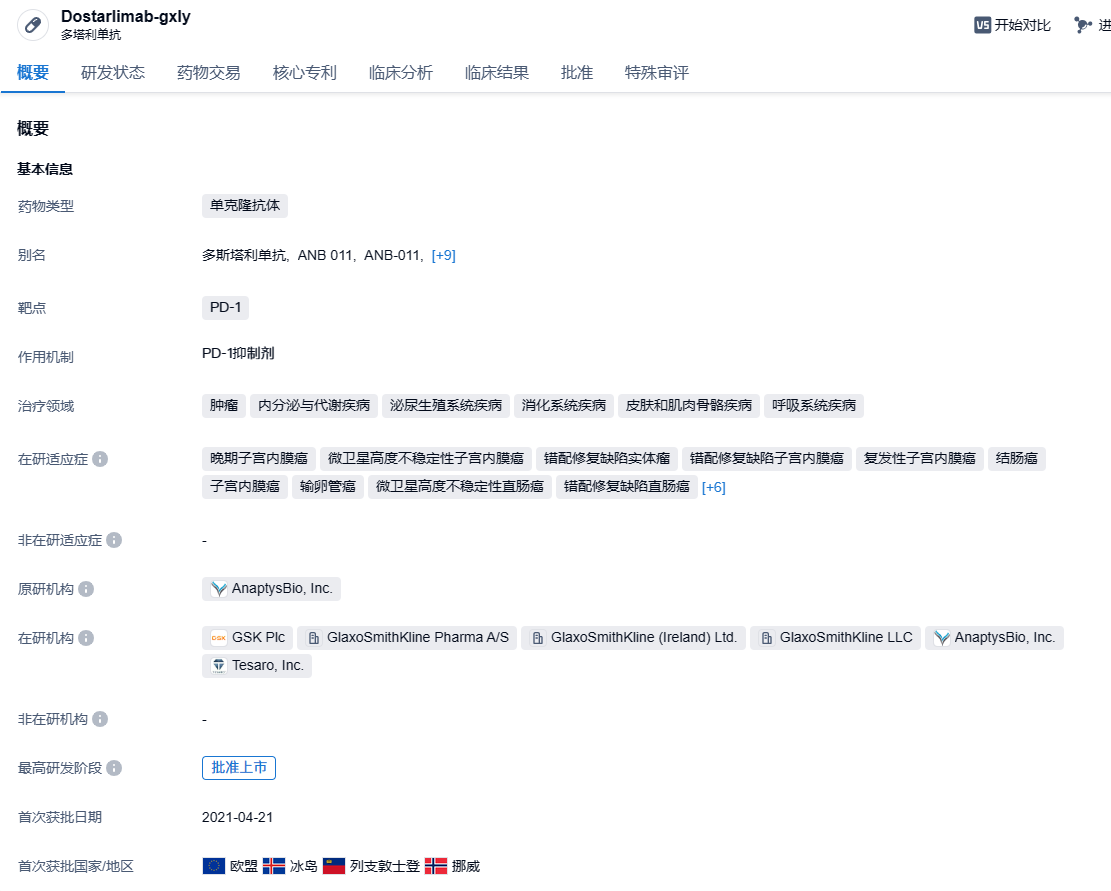
Dostarlimab(Jemperli)是葛兰素史克(GSK)旗下的PD-1单抗,能够与PD-1受体结合,并阻断其与配体PD-L1和PD-L2交互作用的抗体。2021年4月,FDA加速批准Dostarlimab用于治疗此前接受含铂化疗后疾病进展,且存在DNA错配修复缺陷(dMMR)的成人复发性或晚期子宫内膜癌。2021年8月,FDA又加速批准Dostarlimab新适应症上市申请,用于治疗dMMR复发或晚期实体瘤患者。2023年8月1日,美国FDA批准Jemperli(Dostarlimab)与卡铂和紫杉醇联合用药,并接续Jemperli作为单药以治疗由美国FDA批准的检测方法确定为错配修复缺陷型(dMMR)或高度微卫星不稳定性(MSI-H)的原发性晚期或复发性子宫内膜癌成人患者。Dostarlimab是首个获批与化疗联合用于该患者群体一线治疗的免疫肿瘤疗法。2024年8 月 1 日,葛兰素史克宣布,FDA 批准 Dostarlimab 联合卡铂和紫杉醇,随后 Dostarlimab 作为单一药物治疗原发性晚期或复发性子宫内膜癌的成人患者。在此之前,Dostarlimab 已获批用于联合化疗治疗具有错配修复缺陷(dMMR)或微卫星不稳定性高(MSI-H)的原发性晚期或复发性子宫内膜癌成年患者。本次GSK在中国获批新的临床研究,分别针对dMMR/MSI-H结肠癌以及未切除的头颈部鳞状细胞癌。
根据GSK官网披露的管线信息,针对这两项适应症,dostarlimab在国际范围内均处于3期临床研究阶段。其中,AZUR-2是一项3期临床研究,旨在未经治疗的T4N0或III期dMMR/MSI-H可切除结肠癌患者中,比较dostarlimumab单药与标准护理的围手术期治疗的疗效和安全性。临床证据表明,对于多种肿瘤类型,围手术期联合免疫治疗可能进一步改善生存结果。
2024年6月4日,GSK宣布其PD-1抑制剂Jemperli(dostarlimab)替代手术作为错配修复缺陷(dMMR)局部晚期直肠癌一线疗法2期临床试验的更新长期数据。根据新闻稿,该试验在42名完成Jemperli治疗的患者中显示出“前所未见”的100%临床完全缓解率(cCR),前24例评估患者在中位随访26.3个月期间,观察到持续的临床完全缓解。详细数据公布于今年美国临床肿瘤学会(ASCO)年会上。Jemperli用于治疗dMMR/微卫星高度不稳定(MSI-H)直肠和结直肠癌(CRC)的其他注册试验正在招募患者中。
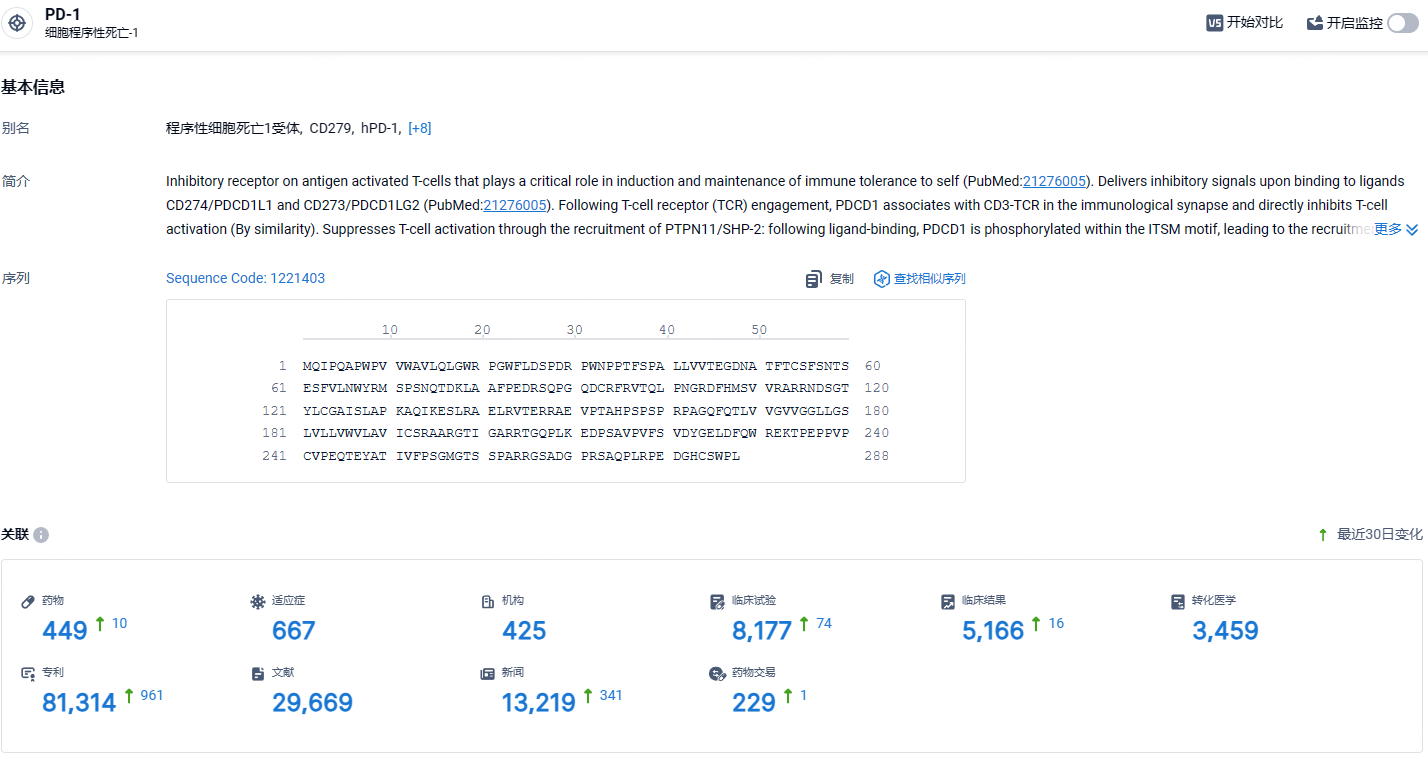
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达PD-1靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年8月8日,PD-1靶点共有在研药物449个,包含的适应症有667种,在研机构425家,涉及相关的临床试验8177件,专利多达81314件……期待Dostarlimab的后续表现。