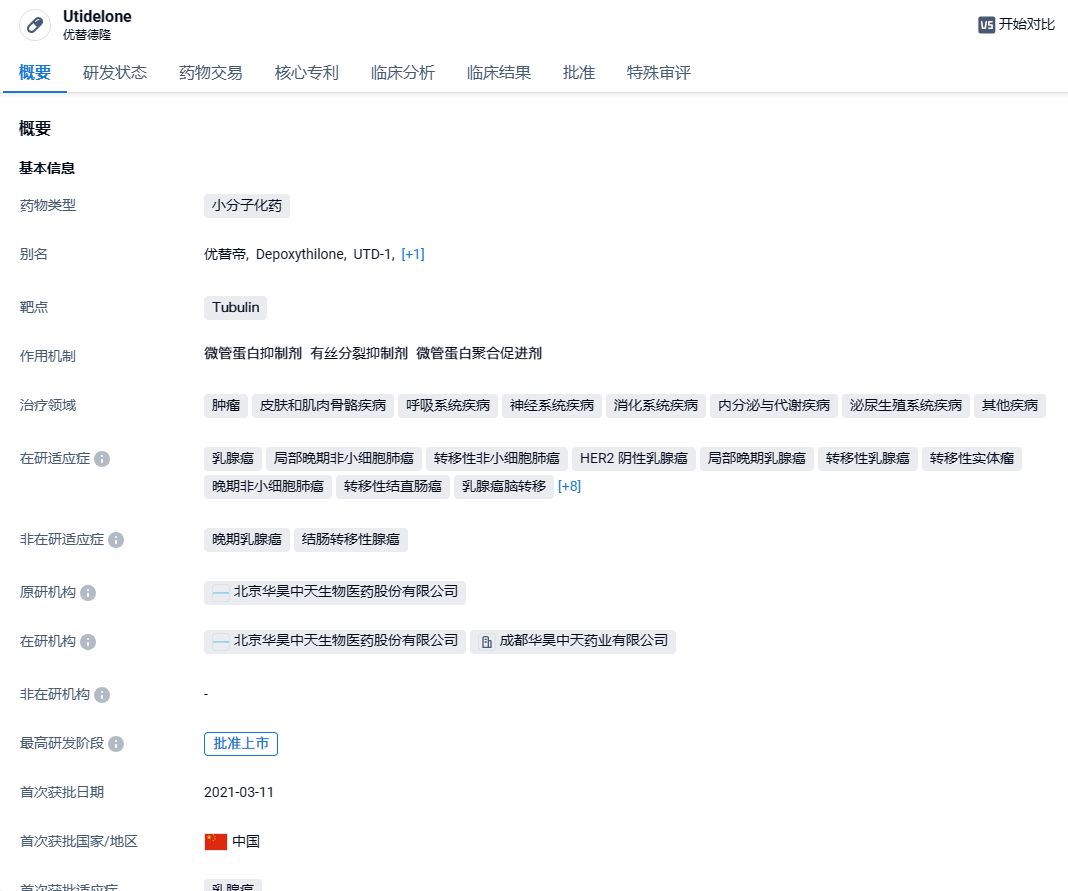
华昊中天优替德隆获FDA孤儿药资格,用于治疗乳腺癌脑转移,CNS-ORR达73%!
2024年3月28日,华昊中天宣布,其核心产品优替德隆注射液获得美国FDA授予的孤儿药资格,用于治疗乳腺癌脑转移。值得一提的是,华昊中天的优替德隆口服胶囊也于今年3月获得FDA授予的孤儿药资格,用于治疗胃癌。
优替德隆为一种基于合成生物学技术成功研发上市的化疗新分子,靶向Tubulin,其与紫杉类作用机制相似但却拥有多方面优势,包括:活性更强、抗癌谱更广、无明显血液学毒性、不易产生耐药性、对紫杉等多药耐药肿瘤依然有效、能够透过血脑屏障、基因工程菌发酵生产环境友好、可口服给药。优替德隆注射液已经于2021年在中国获批上市,用于治疗既往接受过至少一种蒽环类或紫杉类药物化疗方案的复发或转移性乳腺癌患者。
优替德隆独特的理化性质以及对P-糖蛋白介导的外排不敏感等优势,使其具备穿透血脑屏障的能力。该能力已通过动物脑组织分布实验、患者脑肿瘤囊液实验、以及两项针对乳腺癌脑转移的临床研究数据得到充分证实。一项优替德隆联合贝伐珠单抗和依托泊苷治疗HER2阴性乳腺癌脑转移患者II期临床共入组17例患者,中枢神经系统病灶客观缓解率(CNS-ORR)和中枢神经系统病灶临床获益率(CNS-CBR)分别达到73%和91%;另一项优替德隆联合贝伐珠单抗治疗HER2阴性乳腺癌脑转移II期临床共入组46例患者,中位无进展生存期为7.7个月,12个月总生存率达到74.4%。基于上述数据,FDA授予优替德隆注射液治疗乳腺癌脑转移的孤儿药认定。
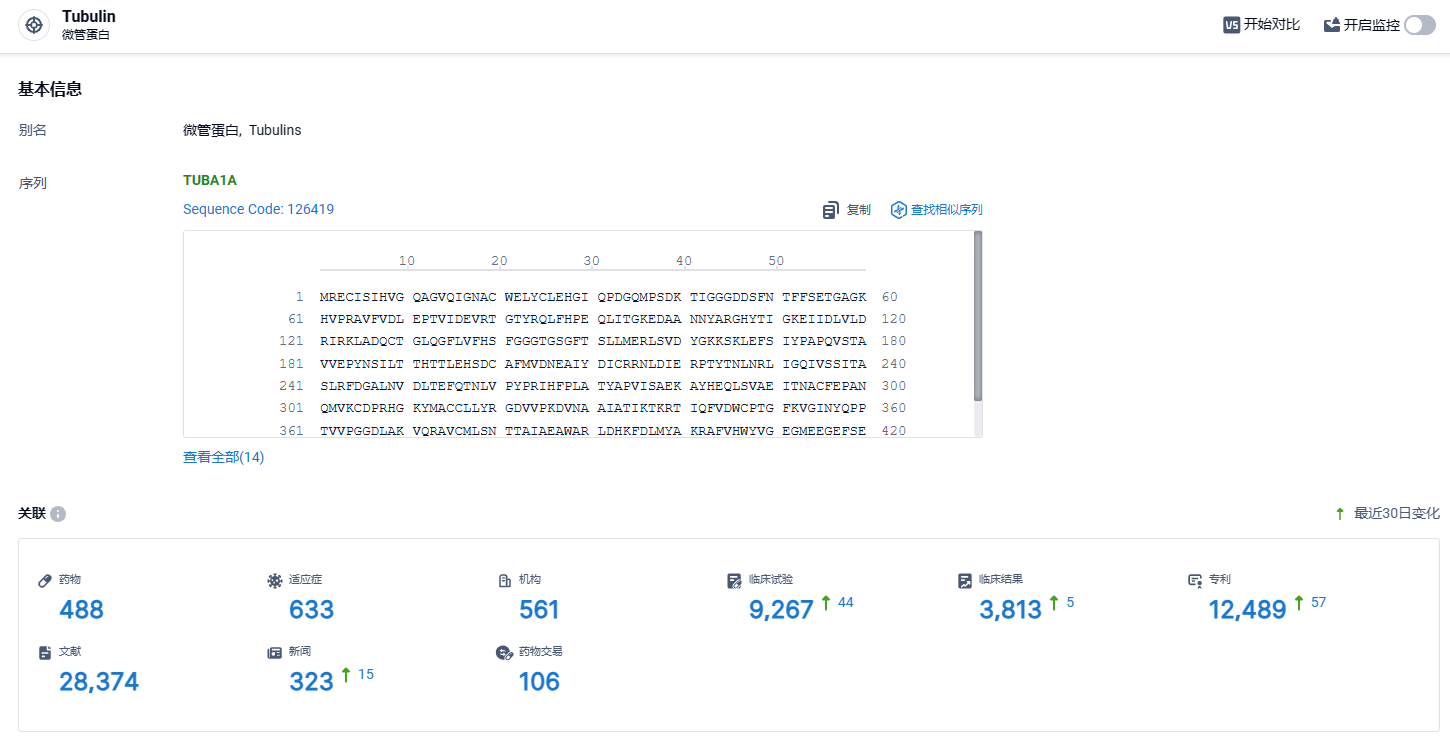
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达Tubulin靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年3月30日,Tubulin靶点共有在研药物488个,包含的适应症有633种,在研机构561家,涉及相关的临床试验9267件,专利多达12489件……“孤儿药”是指用于预防和治疗罕见病的药品。在美国,罕见病是指患病人群小于20万的疾病。由于这类疾病市场规模较小,导致药企研发回报率较低。为让患者有药可医,美国在1983推出了孤儿药法案,从多个层面激励孤儿药的研发。获得FDA授予的孤儿药资格认定后,在美国的后续研发及商业化将会享受多方面政策支持,包括临床试验费用税收减免、免除新药申请费用、获得研发资助、加快审批等,特别是该药物的该适应症批准上市后可获得美国市场7年独占权。期待优替德隆能够在美国研发顺利。