礼来GIP/GLP-1受体双重激动剂「替尔泊肽」在华申报第四项适应症
11月22日,CDE网站最新公示,礼来GIP/GLP-1受体双重激动剂替尔泊肽注射液新适应症上市申请获得受理。这是替尔泊肽在中国递交的第四项上市申请,业界推测,此次适应症可能是在饮食控制和运动的基础上,联合基础胰岛素,用于改善成人2型糖尿病患者(T2DM)的血糖控制。
tirzepatide(中文名:替尔泊肽)是由礼来制药开发的每周一次注射的葡萄糖依赖性促胰岛素多肽(GIP)和胰高糖素样肽-1(GLP-1)的单分子双受体激动剂,曾在大型 III 期临床中头对头击败司美格鲁肽,也是首个且目前唯一获得全球批准的GIPR x GLP-1R受体激动剂。2022年5月,该药获得美国FDA批准(商品名:Mounjaro),用于与控制饮食和锻炼联用,改善成人2型糖尿病患者的血糖控制。减肥适应症方面,礼来在美国进行了4项三期临床,全部取得成功。2023年11月9日, Zepbound(tirzepatide)获美国FDA批准,用以使肥胖或超重成年患者减轻体重并保持体重稳定。这些患者患有体重相关共病,包含高血压、血脂异常、2型糖尿病、阻塞性睡眠呼吸暂停或心血管疾病。
 2024年5月21日,替尔泊肽在中国获得批准,用于改善成年2型糖尿病患者的血糖控制。同年7月19日,该药物在中国作为减肥药成功上市,用于在低热量饮食和增加运动的基础上,改善成人肥胖或伴有至少一种体重相关疾病的超重患者的长期体重管理。截至目前,替尔泊肽在中国的临床试验默示许可已达到66项,涵盖的适应症包括2型糖尿病、2型糖尿病合并高危心血管风险治疗、超重或肥胖患者的长期体重管理,以及中重度阻塞性睡眠呼吸暂停(OSA)等。
2024年5月21日,替尔泊肽在中国获得批准,用于改善成年2型糖尿病患者的血糖控制。同年7月19日,该药物在中国作为减肥药成功上市,用于在低热量饮食和增加运动的基础上,改善成人肥胖或伴有至少一种体重相关疾病的超重患者的长期体重管理。截至目前,替尔泊肽在中国的临床试验默示许可已达到66项,涵盖的适应症包括2型糖尿病、2型糖尿病合并高危心血管风险治疗、超重或肥胖患者的长期体重管理,以及中重度阻塞性睡眠呼吸暂停(OSA)等。
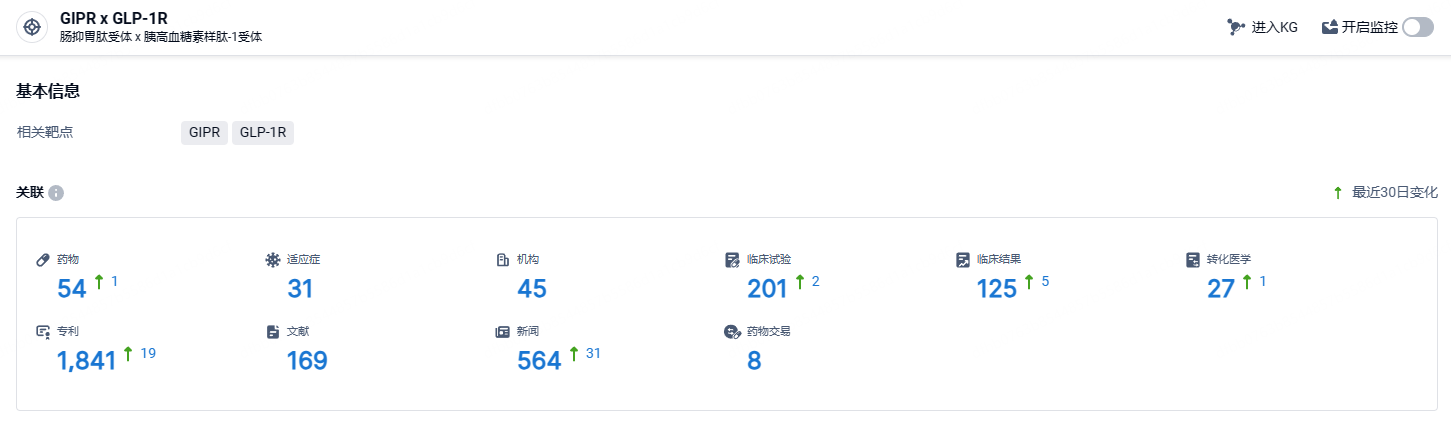
根据智慧芽新药情报库所披露的信息 (点击下方图片直达GIPR x GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年11月24日,GIPR x GLP-1R靶点共有在研药物54个,包含的适应症有31种,在研机构45家,涉及相关的临床试验201件,专利多达1841件……tirzepatide临床试验数据优秀,在降糖和减重领域具有非常大的市场潜力,2024年前三季度替尔泊肽合计销售额为110.28亿美元,其中,降糖版Mounjaro®销售额80.10亿美元,减重版Zepbound®销售额30.18亿美元。期待其能再创佳绩!