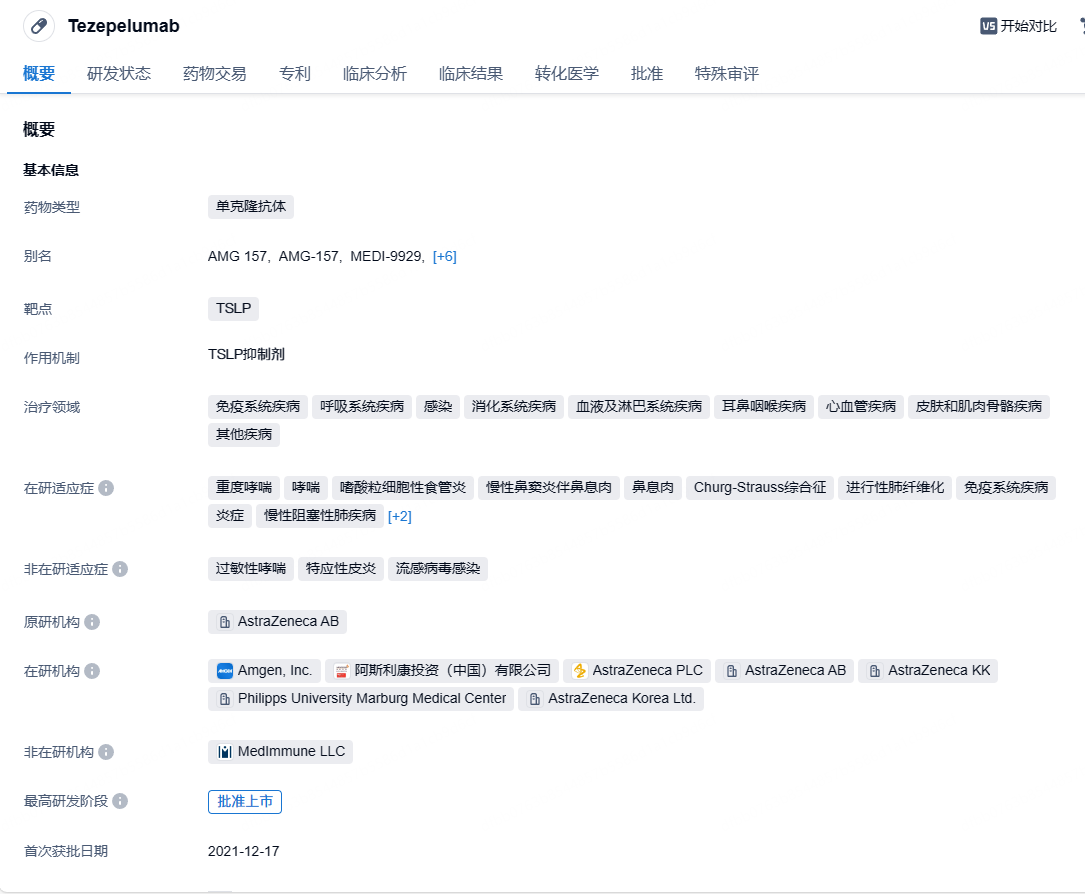
阿斯利康/安进TSLP单抗特泽利尤单抗在华申报上市,针对严重哮喘
11月22日,CDE官网公示,阿斯利康和安进共同申报的特泽利尤单抗注射液上市申请已获得受理。这是靶向抗胸腺基质淋巴细胞生成素(TSLP)的单克隆抗体tezepelumab(Tezspire)。阿斯利康官网管线信息也指出,拟在中国市场申报该药的首个适应症为治疗严重哮喘。
特泽利尤单抗(Tezepelumab)是一款“first-in-class”人源性、靶向抗胸腺基质淋巴细胞生成素(TSLP)的单克隆抗体。TSLP是位于许多炎症级联反应顶端的上皮细胞因子,能引发对过敏性、嗜酸性和其他类型气道炎症的过度免疫反应。该疗法在2021年12月获美国FDA批准作为附加维持疗法,治疗12岁以上儿童和成人严重哮喘患者。之后陆续在欧盟、日本被批准用于治疗重度哮喘。该药物突破了治疗嗜酸性哮喘的局限,是唯一一个没有表型或生物标志物限制的生物制剂。
此前FDA这一批准是基于名为PATHFINDER的临床开发项目,包括关键性3期临床试验NAVIGATOR的结果。NAVIGATOR试验结果于2021年5月发表在《新英格兰医学杂志》上。试验结果显示,在治疗症状未受控制的重度哮喘患者时,tezepelumab达到试验所有主要终点和关键性次要终点。与安慰剂相比,将每年哮喘急性加重率(AAER)降低56%。 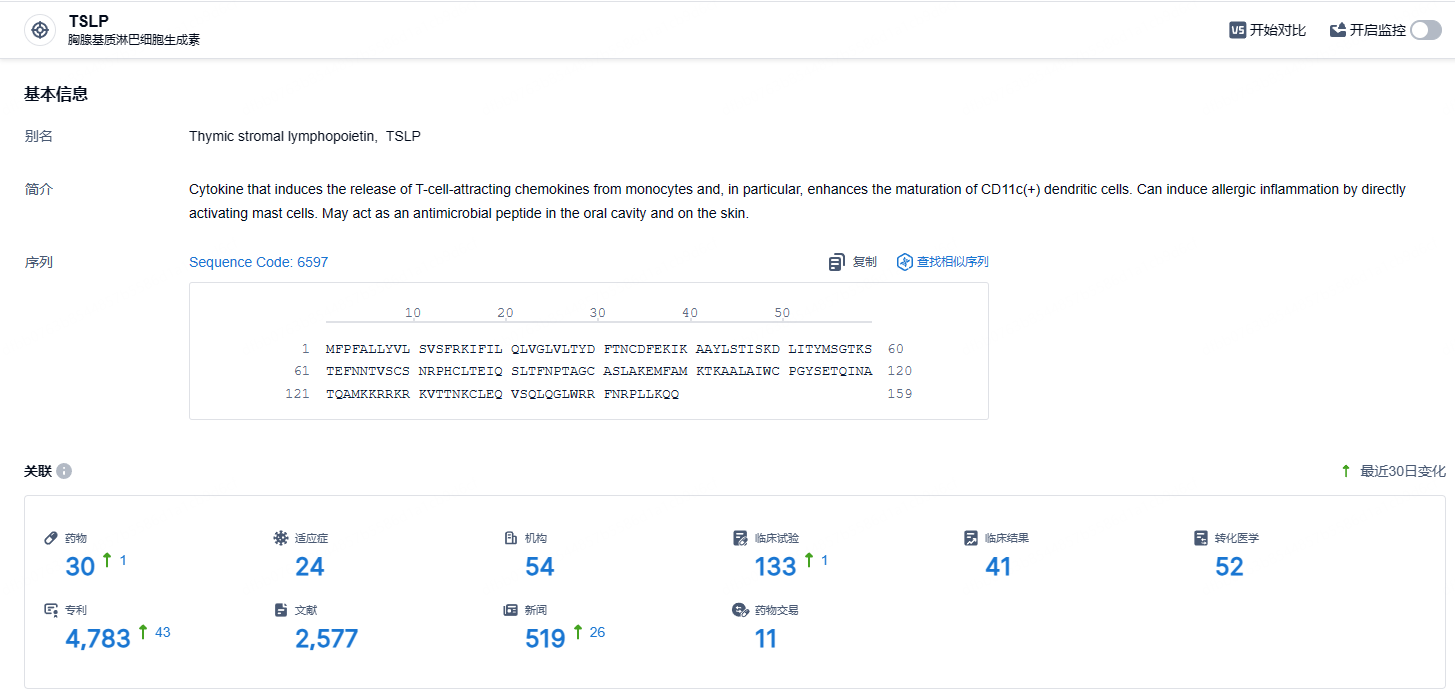
根据智慧芽新药情报库所披露的信息 (点击下方图片直达TSLP靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年11月24日,TSLP靶点共有在研药物30个,包含的适应症有24种,在研机构54家,涉及相关的临床试验133件,专利多达4783件……Tezepelumab作为一种用于治疗严重哮喘的生物制剂,通过阻断TSLP-TSLPR相互作用发挥着治疗作用。对于药物依赖性哮喘患者,Tezepelumab也表现出了良好的耐受性。Tezepelumab在治疗未受控制的重度哮喘方面展现出了显著的临床疗效,为哮喘患者带来了新的治疗选择。