嘉和生物CDK4/6抑制剂来罗西利新适应症申报上市,一线治疗晚期乳腺癌
2024年3月13日,嘉和生物宣布,中国国家药品监督管理局(NMPA)已受理盐酸来罗西利片新适应症上市申请,即联合来曲唑治疗既往未经过系统性抗肿瘤治疗的激素受体(HR)阳性、人表皮生长因子受体2(HER2)阴性(HR+/HER2-)晚期乳腺癌患者。
来罗西利(GB491,Lerociclib)是由嘉和生物和美国G1 Therapeutics共同开发的一款用于治疗乳腺癌的高选择性口服型CDK4/6抑制剂。嘉和生物于2020年6月向G1 Therapeutics取得亚太地区(不包括日本)的专有权许可。此前,来罗西利片用于与氟维司群联用治疗既往接受内分泌治疗后疾病进展的HR+/HER2-局部晚期或转移性乳腺癌的新药上市许可申请已于2023年3月28日获得受理,并已顺利完成临床现场核查。
在针对乳腺癌的多个临床前模型及临床试验中,lerociclib已表现出明显的疗效。在联合氟维司群的1/2a期试验中,该产品治疗后患者的客观缓解率(ORR)达31.6%,同时具有良好的安全性和耐受性。在ER阳性/HER2阴性乳腺癌患者中的初步临床数据显示,lerociclib疗效明显,耐受性良好,可以通过较低的剂量限制性毒性和可能较少的病患监护来连续给药。
在2023年6月4日举行的转移性乳腺癌环节中,嘉和生物旗下来罗西利(Lerociclib,GB491)以壁报讨论(Poster Discussion Session)形式展示了细胞周期蛋白依赖性激酶 (CDK) 4/6抑制剂来罗西利 (Lerociclib,GB491) 联合氟维司群(Fulvestrant) 治疗HR+/HER2-晚期乳腺癌患者的III期临床研究LEONARDA-1 的数据。LEONARDA-1研究是一项比较来罗西利(Lerociclib,GB491)联合氟维司群(Fulvestrant)与安慰剂联合氟维司群的III期临床试验。截至2022年12月的数据显示,研究组的临床试验主要终点无进展生存期(PFS)显著优于对照组。
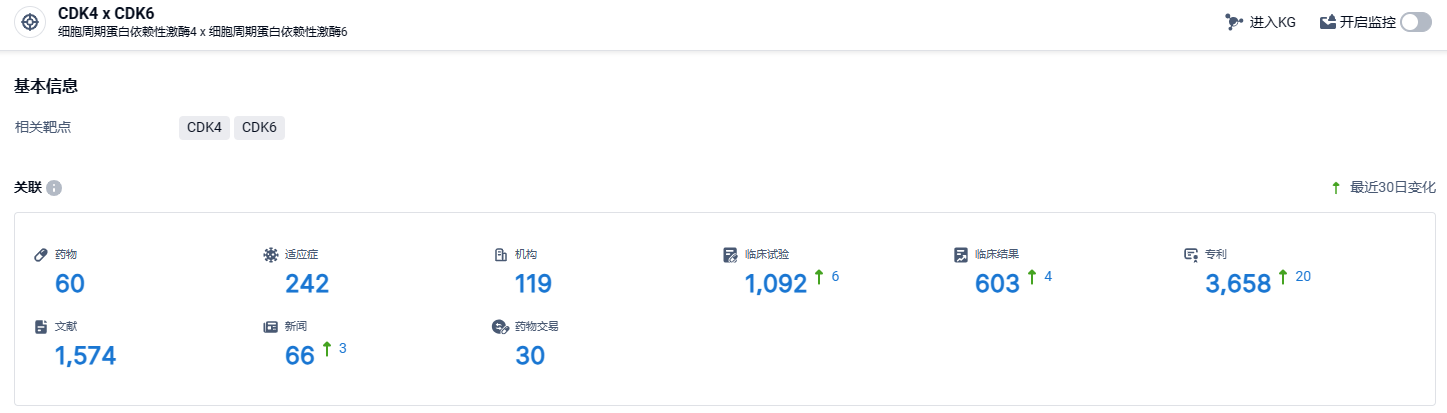
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CDK4 x CDK6靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年3月15日,CDK4 x CDK6靶点共有在研药物60个,包含的适应症有242种,在研机构119家,涉及相关的临床试验1093件,专利多达3658件……根据一篇来自Nature Reviews Drug Discovery上文章的数据显示2019年乳腺癌市场总额为202亿美元,其中HER2靶向药物和CDK4/6抑制剂占销售额的68%。全球乳腺癌市场到2029年可达500亿美元,保持9%的年复合增长率。其中,随着CDK4/6抑制剂新药的逐渐获批结合适应症的拓展,CDK4/6抑制剂在2029年的预计销售额将达到200亿美元,占据乳腺癌市场的半壁江山。期待来罗西利能够顺利上市,在该赛道占据一席之地。