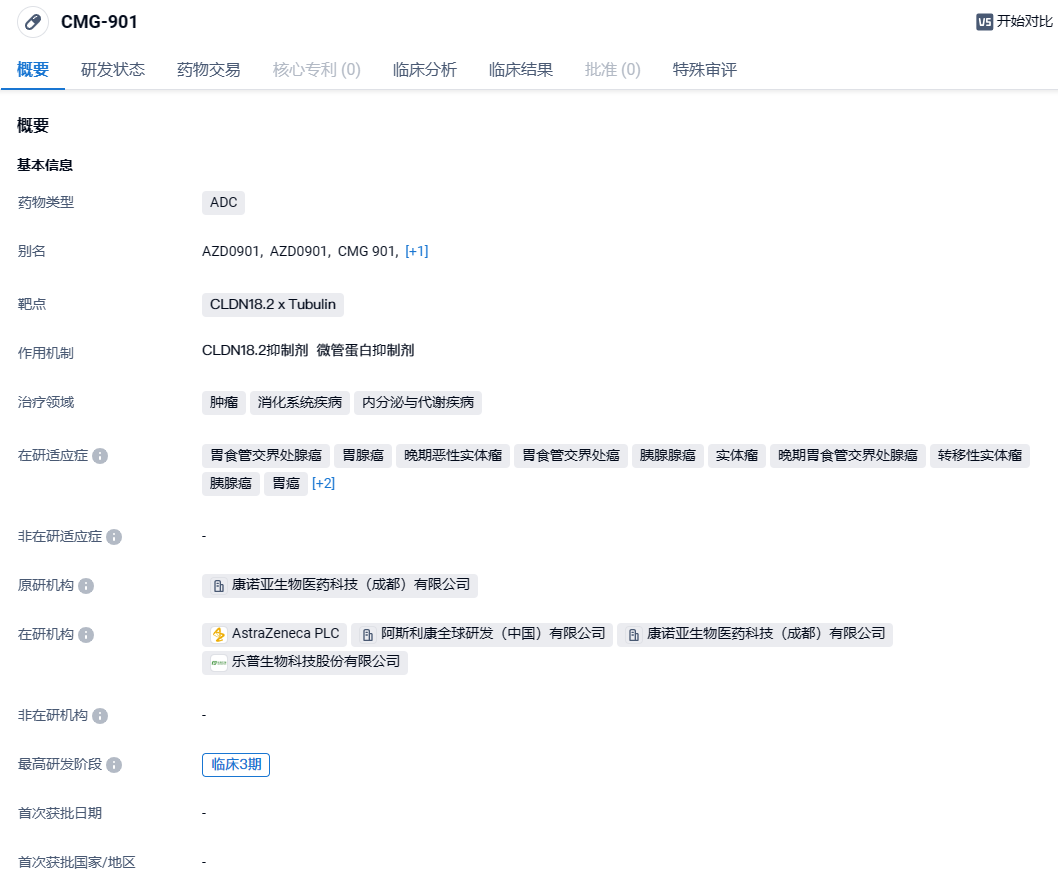
超11亿美元引进!阿斯利康靶向Claudin18.2的ADC AZD0901在中国启动3期临床
近日,中国药物临床试验登记与信息公示平台官网公示,阿斯利康(AstraZeneca)在中国启动了一项国际多中心(含中国)3期临床研究,以评估AZD0901(曾用名:CMG901)治疗晚期或转移性胃及胃食管结合部腺癌的有效性和安全性。
AZD0901是一款靶向CLDN18.2的全新重组人源化单克隆抗体偶联药物,由抗Claudin18.2单克隆抗体、可裂解的链接体和细胞毒性小分子单甲基澳瑞他汀E(MMAE)组成。该产品可通过多种机制杀伤肿瘤细胞:1)可通过Claudin18.2抗体部分特异结合Claudin18.2阳性细胞,并内吞进入细胞溶酶体,释放MMAE,进而导致肿瘤细胞的细胞周期停滞并诱发细胞凋亡;2)可激活免疫防御,通过抗体依赖的细胞毒性作用(ADCC)和补体依赖的细胞毒性作用(CDC)效应杀伤Claudin18.2阳性细胞。该产品此前已经获美国FDA授予孤儿药资格及快速通道资格,并被中国国家药监局药品审评中心(CDE)纳入突破性治疗品种。2023年2月,康诺亚和乐普生物共同宣布与阿斯利康就CMG-901达成全球独家授权协议。根据许可协议,KYM Biosciences Inc.获得6300万美元的预付款和超过11亿美元的潜在额外研发和销售相关的里程碑付款,以及高达低双位数的分层特许权使用费。阿斯利康获得CMG-901研究、开发、注册、生产和商业化的独家全球许可。
2023年11月8日,康诺亚(香港联交所股份代码:02162)宣布,其靶向Claudin 18.2(CLDN18.2)的抗体偶联药物CMG901(亦称 AZD0901)治疗晚期胃癌╱胃食管结合部腺癌的I期临床研究最新数据在2023年11月美国临床肿瘤学会全体大会系列会议(ASCO Plenary Series)上以口头报告形式发布。
KYM901研究(NCT04805307)的目的是评价CMG901在晚期实体瘤受试者中的安全性和耐受性、药代动力学特征、免疫原性及初步有效性。截至2023年7月24日,2.2mg/kg、2.6mg/kg、3.0mg/kg三个剂量组共纳入113例胃癌╱胃食管结合部腺癌患者(分别为44、50、19例)。所有受试者均接受了至少一线的标准治疗(既往中位治疗线数为2线),74%的受试者既往接受过抗PD-1/PD-L1治疗。
安全性方面,与药物有关的≥3级治疗期间出现的不良事件发生率为54%,与药物有关的严重不良事件发生率为31%,8%的受试者因药物相关的不良事件停止用药。
89例可评估的Claudin 18.2阳性胃癌或胃食管结合部腺癌患者在三个剂量组的确认的客观缓解率(ORR)为33%,确认的疾病控制率(DCR)为70%。其中,2.2mg/kg剂量组确认的ORR为42%,中位无进展生存期(mPFS)为4.8个月,中位总生存期(mOS)尚未达到。
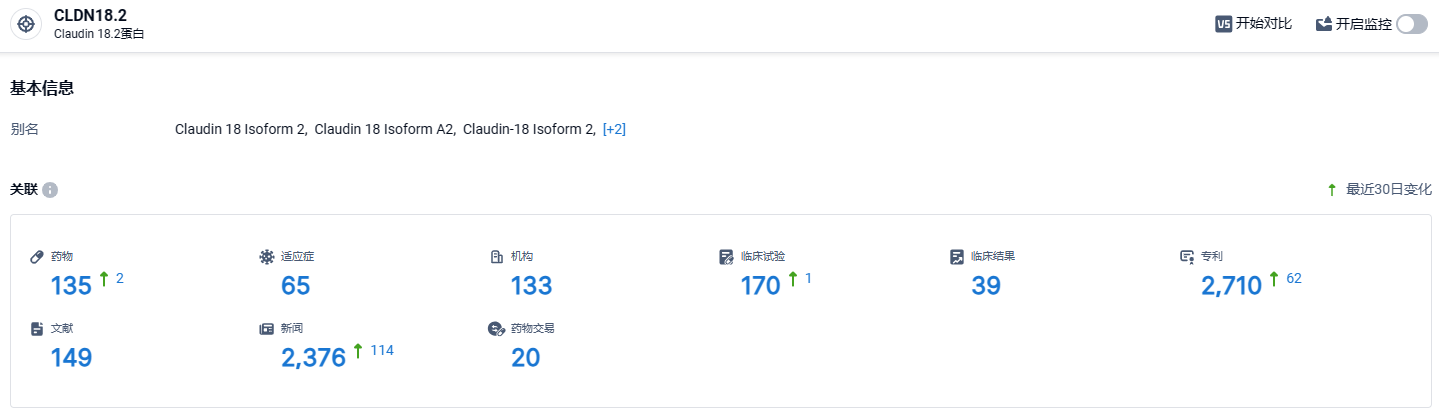
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CLDN18.2 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年3月14日,CLDN18.2靶点共有在研药物135个,包含的适应症有65种,在研机构133家,涉及相关的临床试验170件,专利多达2710件……热门靶点CLDN18.2,在国内外已经形成了十分激烈的研发环境。目前,已经开发了针对CLDN 18.2进行癌症治疗的多项免疫疗法,包括单克隆抗体、双特异性抗体(BsAbs)、CAR-T细胞和ADC疗法。AZD0901是世界上第一个进入临床开发的CLDN 18.2 ADC,期待该药能够研发顺利。