强生IL-23抑制剂古塞奇尤单抗向FDA递交监管申请,针对溃疡性肠炎
近日,强生(Johnson & Johnson)宣布向美国FDA递交补充生物制品许可申请(sBLA),寻求批准其抗IL-23抗体Tremfya(guselkumab)用于治疗中重度活动性溃疡性肠炎(UC)成人患者。
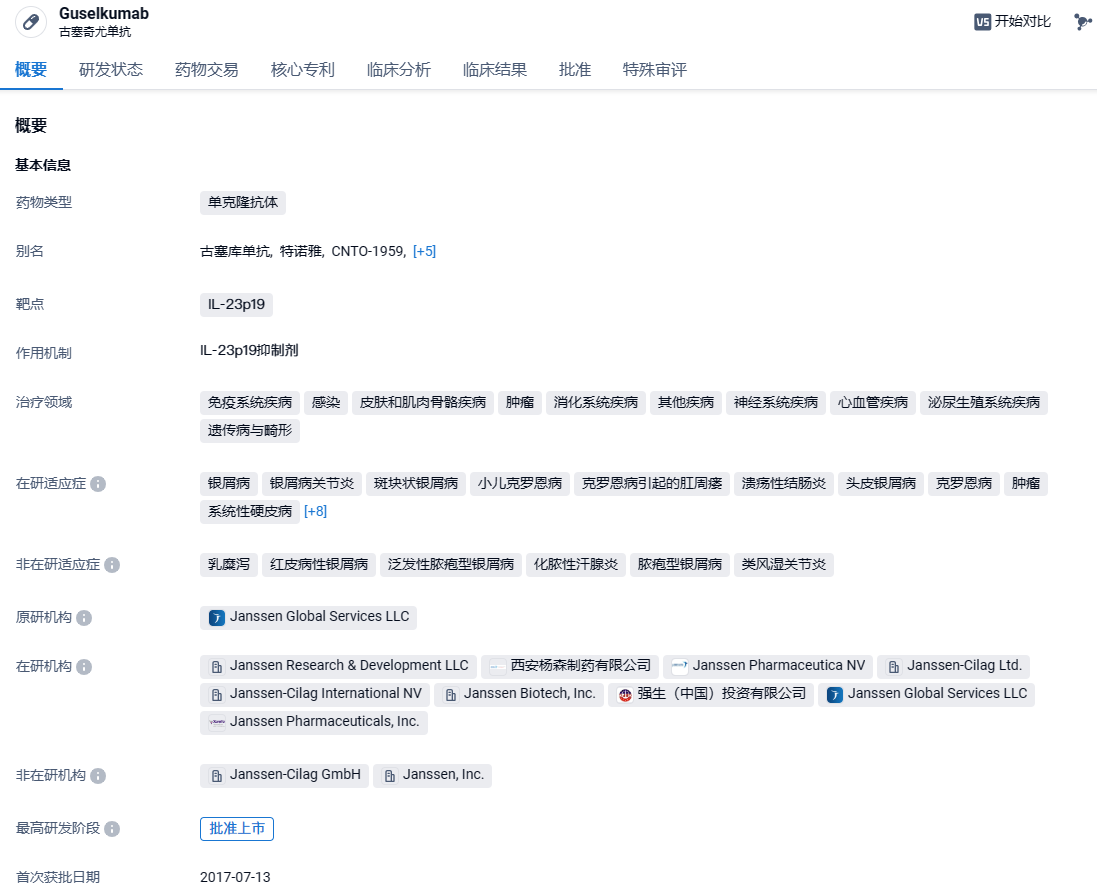
古塞奇尤单抗(Guselkumab,Tremfya)是强生旗下杨森制药研发的一款靶向IL-23的p19亚基的单克隆抗体,同时也是杨森研发的全球首个上市的靶向IL-23的单抗药物。IL-23是炎症性疾病发病机制的重要驱动因素。目前,guselkumab已在美国、加拿大、日本和许多其他国家/地区获得批准,用于治疗中重度斑块状银屑病,以及银屑病关节炎。2019年,古塞奇尤单抗在中国获批,用于适合全身性治疗的中重度斑块状银屑病成人患者。
此次递交sBLA是基于一项3期临床试验QUASAR的结果。数据显示,患者在症状、患者报告的结果(如疲劳)和疾病活动性指标(包括内窥镜和组织学缓解等终点)上具有统计学和临床意义的改善。安全性结果与Tremfya在获批适应症中的已知安全性一致。QUASAR 3期诱导研究是一项随机双盲、安慰剂对照、平行组、多中心研究,旨在评估guselkumab作为对中重度活跃的UC患者诱导疗法的疗效和安全性,这些UC患者对传统(即巯嘌呤类药物或皮质类固醇)治疗和/或先进疗法(即TNF-α拮抗剂、vedolizumab或tofacitinib)的应答不足或不能耐受。这次所公布的试验结果显示,单次静脉注射(IV)诱导剂量的guselkumab一周后就观察到症状缓解以及患者报告的直肠出血和排便绝对数结果的改善。安全性方面,没有发现新的安全信号。在接受guselkumab治疗的患者中,最常见的不良事件是COVID-19(7.2%)、贫血(5.1%),和UC恶化(4.6%)。Guselkumab是一款通过与IL-23受体的p19亚基结合,选择性抑制IL-23信号传导的人源化单克隆抗体。
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 IL-23 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年3月14日,IL-23 靶点共有在研药物43个,包含的适应症有42种,在研机构77家,涉及相关的临床试验274件,专利多达11597件……白细胞介素是一个很大的家族,有多种亚型,功能各异,有些与自身免疫疾病相关,也有些与肿瘤疾病相关。靶向IL-12/23的乌司奴单抗、靶向IL-23的瑞莎珠单抗和古塞奇尤单抗、靶向IL-4的度普利尤单抗、靶向IL-17的司库奇尤单抗和依奇珠单抗和靶向IL-6的托珠单抗,这些药物主要用于治疗自身免疫相关的疾病,如斑块状银屑病、银屑病关节炎、克罗恩病、溃疡性结肠炎和风湿性关节炎等。期待古塞奇尤单抗在竞争中脱颖而出。