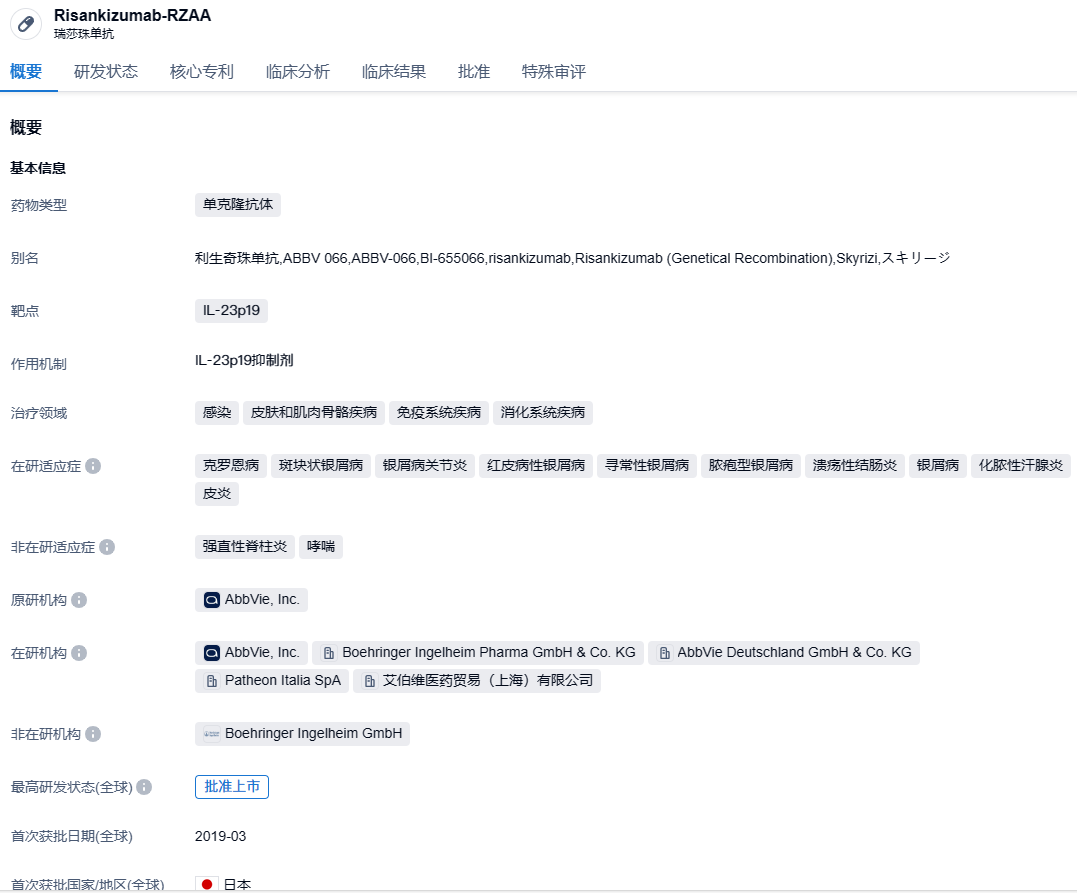
头对头乌司奴单抗!艾伯维IL-23单抗risankizumab III期研究取得积极结果
2023年9月12日,艾伯维宣布利生奇珠单抗(Risankizumab)对比乌司奴单抗(ustekinumab)治疗中重度克罗恩病的III期SEQUENCE研究达到了所有的主要终点和次要终点。
Risankizumab是一种白细胞介素-23(IL-23)抑制剂,通过与其p19亚基结合选择性阻断IL-23。IL-23是一种参与炎症过程的细胞因子,被认为与许多慢性免疫介导的疾病有关。Risankizumab首次获批时间为2019年4月,已获FDA和EMA批准的两项适应症分别为银屑病性关节炎和斑块状银屑病。Skyrizi上市首年大卖3.55亿美元,第二年销量达到15.9亿美元,2022全球销售额已经达到51.65亿美元。此外,Risankizumab还有多项自身免疫疾病相关适应症的研发进度正在积极推动中。2023年7月6日,艾伯维利生奇珠单抗(risankizumab)注射液及其皮下注射剂型国内上市申请获国家药监局药审中心受理。2023年8月29日,艾伯维(AbbVie)已向美国FDA和欧洲EMA递交Skyrizi(Risankizumab)治疗中度至重度溃疡性结肠炎(UC)成人患者的新适应症申请。
SEQUENCE研究是一项多中心、随机、头对头III期临床试验,共纳入527例接受过一种或多种抗肿瘤坏死因子(TNF)药物治疗的中重度克罗恩病患者。所有患者的基线克罗恩病活动指数(CDAI)为220-450分。研究的主要终点为第24周实现临床缓解(定义为CDAI低于150分)的患者比例和第48周实现内镜缓解(定义为克罗恩病简化内镜下评分(SES-CD)分数≤4分且相比基线至少降低2分,任何子评估项得分不能超过1分)的患者比例。结果显示,利生奇珠单抗组患者的临床缓解率非劣效于乌司奴单抗组(59% vs. 40%);内镜缓解率优效于乌司奴单抗组(32% vs. 16%,P<0.0001)。此外,利生奇珠单抗的安全性与既往研究中观察到的情况一致,没有发现新的安全风险。最常见的不良事件是COVID-19和头痛。
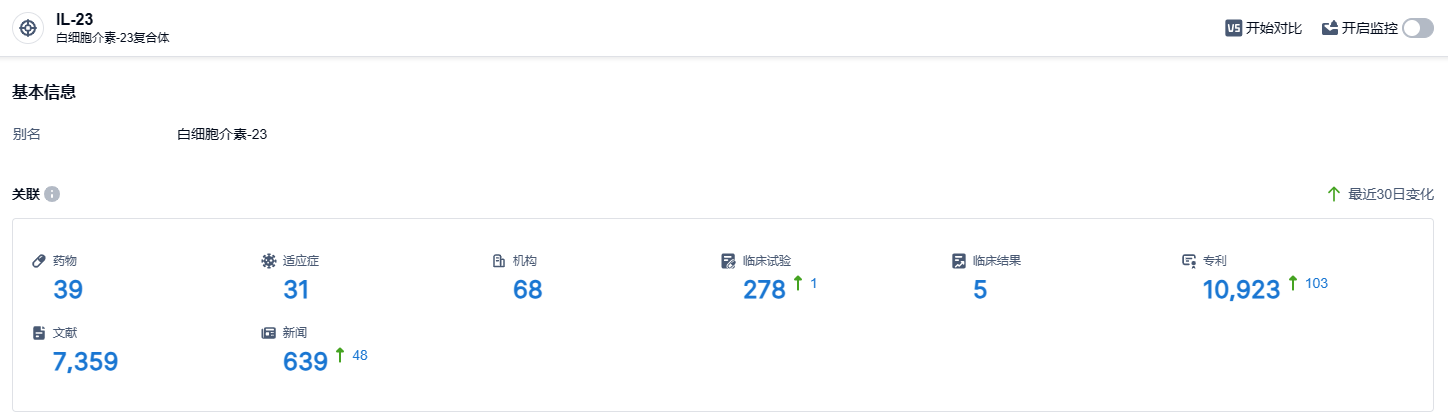
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 IL-23 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月14日,IL-23 靶点共有在研药物39个,包含的适应症有31种,在研机构68家,涉及相关的临床试验278件,专利多达10923件……Risankizumab自2019年上市以来,销售持续保持高速增长的态势,全球三大药物市场,唯独还未在中国获批上市,相信未来进入中国市场后,将会创造新的销售奇迹。