和美药业PDE4抑制剂莫米司特片拟纳入优先审评,针对斑块状银屑病
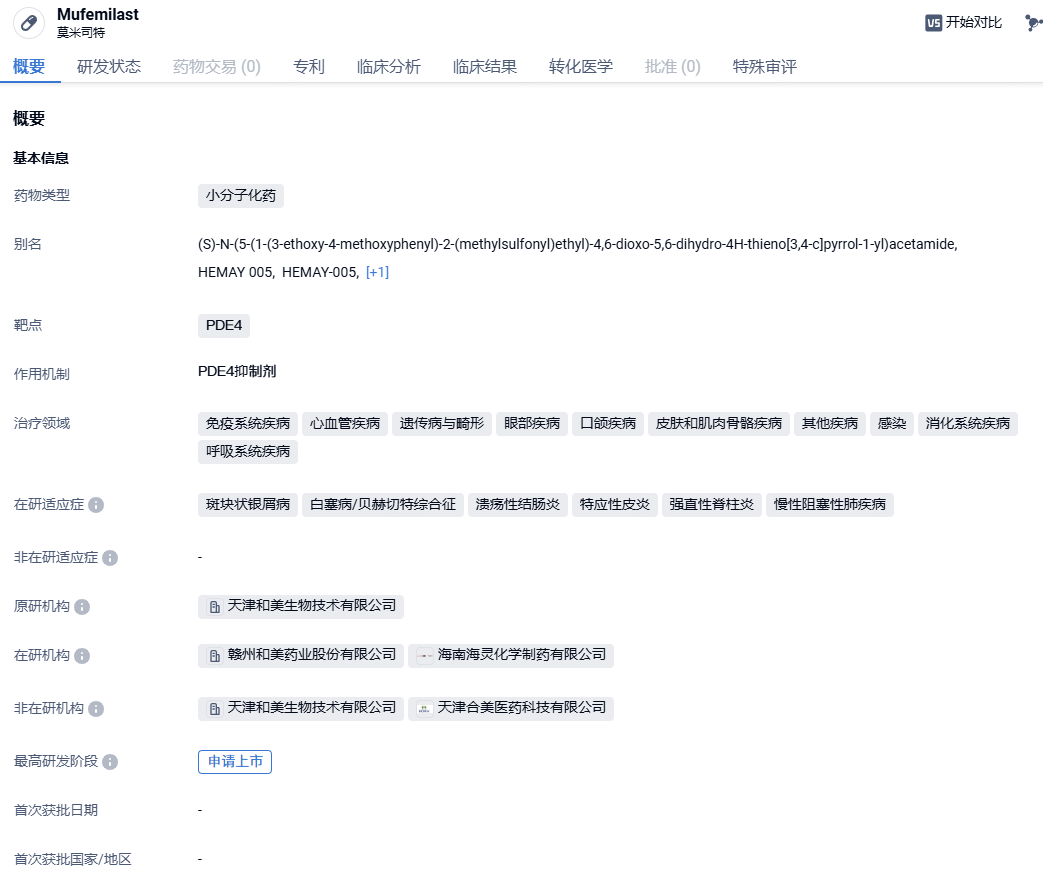
2024年5月30日,中国国家药监局药品审评中心(CDE)官网公示,和美药业申报的PDE4抑制剂莫米司特片(Hemay005片)拟纳入优先审评,针对适应症为中度至重度斑块状银屑病。
莫米司特片(Hemay005)是由和美药业自主研发小分子PDE4抑制剂,除已经递交NDA并获受理的斑块状银屑病(PS)之外,还获得了:白塞氏综合征(BD)、银屑病性关节炎(PsA)、溃疡性性结肠炎(UC)、强直性脊柱炎(AS)、特应性皮炎(AD)、慢性阻塞性肺炎(COPD),6个适应症的临床批件(IND)。
作为PDE家族的一员,PDE4可通过特异性水解cAMP而调控促炎、抗炎细胞因子的产生,从而发挥一系列作用。目前,研究人员正在开发PDE4抑制剂用于治疗多种炎症性疾病,包括银屑病、强直性脊柱炎、特应性皮炎、类风湿关节炎、系统性红斑狼疮等等。全球范围内已有多款PDE4抑制剂获批上市。
莫米司特片已经完成治疗中重度斑块状银屑病的临床3期试验。其中,在该研究中,接受莫米司特片治疗16周的患者中达成PASI75的比例53.6%;持续使用达成PASI75的比例进一步提升到70%以上。同时,在该试验中,和美药业还在治疗银屑病的试验中纳入了上百例T-SPOT检测阳性的非活动结核患者,试验过程中无重新激活结核发病现象。
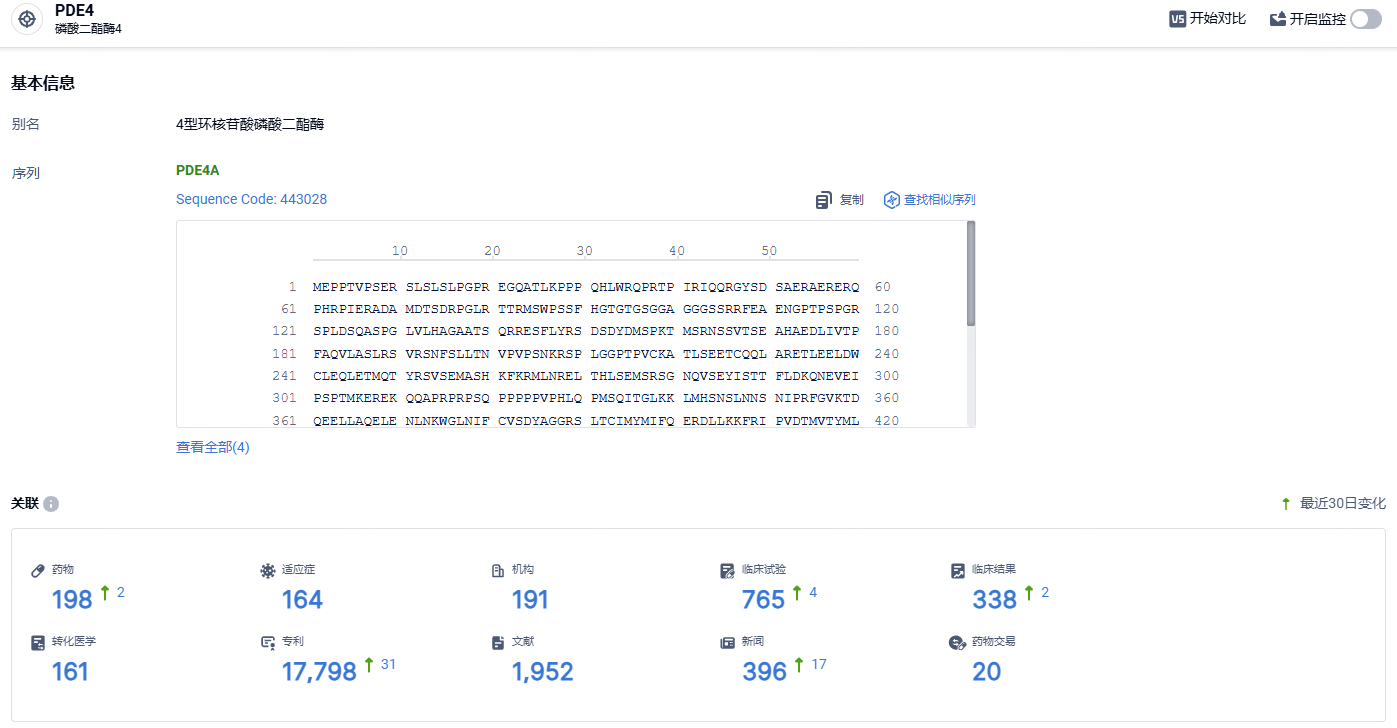
根据智慧芽新药情报库所披露的信息(点击下方图片直达PDE4靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年6月1日,PDE4靶点共有在研药物198个,包含的适应症有164种,在研机构191家,涉及相关的临床试验765件,专利多达17798件……由于莫米司特片治疗白塞氏综合征(BD)的临床2期中期分析数据显示较好疗效和安全性,其已经获美国FDA授予孤儿药资格,目前正在针对该适应症开展临床3期试验。该产品还已经获得了治疗银屑病性关节炎、溃疡性性结肠炎、强直性脊柱炎、特应性皮炎、慢性阻塞性肺炎的临床试验批件。期待莫米司特早日获批,为国内患者带来新的治疗选择。