百时美施贵宝靶向CD19 CAR-T疗法再获FDA加速批准,针对套细胞淋巴瘤
2024年5月31日,百时美施贵宝(Bristol Myers Squibb)宣布,美国FDA已批准其CAR-T疗法Breyanzi(lisocabtagene maraleucel;liso-cel)的扩展适应症,用于既往接受过至少2线系统性疗法的复发性或难治性套细胞淋巴瘤(MCL)成人患者,包括曾接受过布鲁顿酪氨酸激酶(BTK)抑制剂治疗的患者。Breyanzi是首个获美国FDA批准用于治疗四种不同亚型非霍奇金淋巴瘤的CAR-T疗法,使之能够治疗广泛的B细胞恶性肿瘤患者群体。
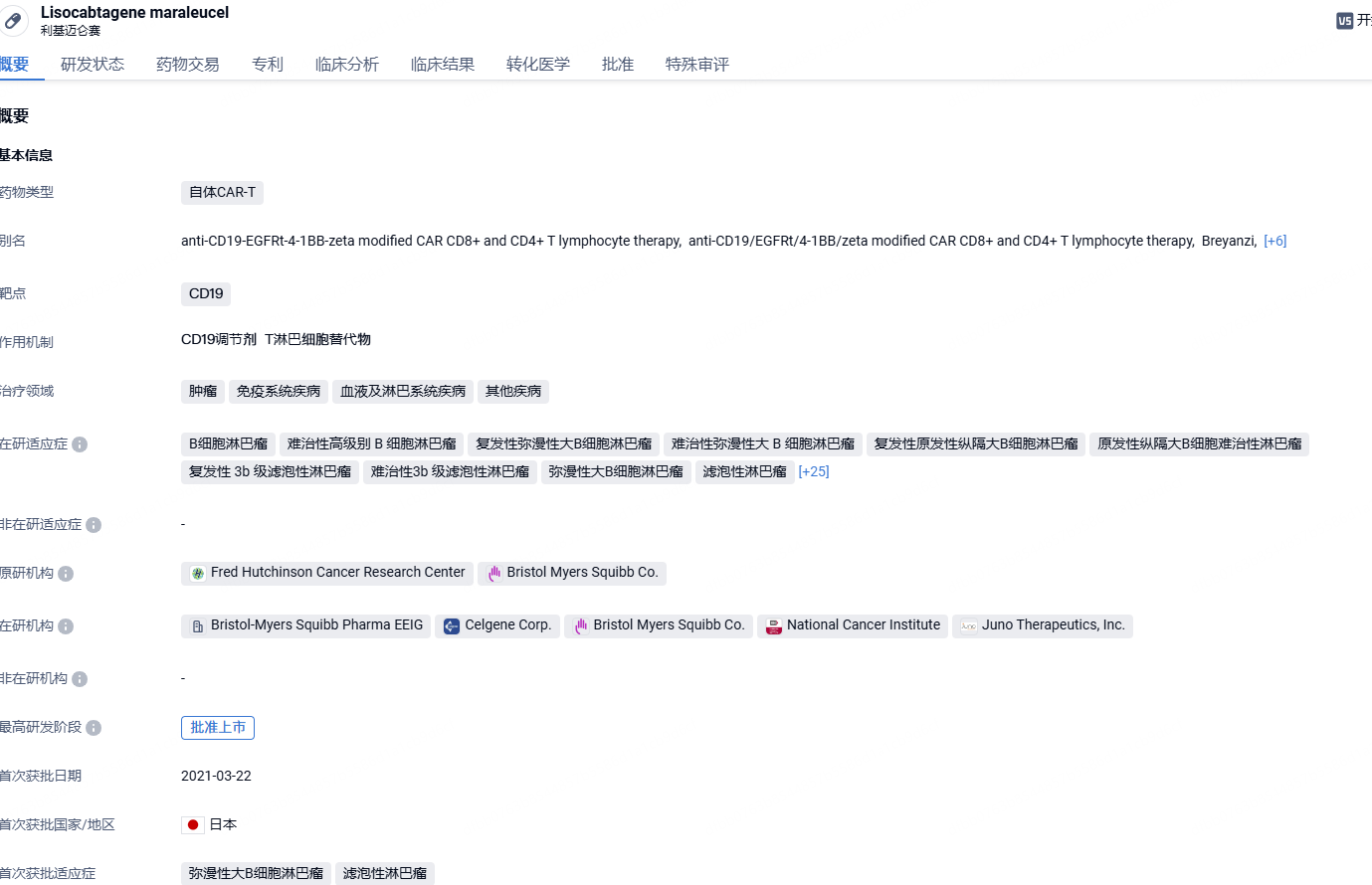
Breyanzi(lisocabtagene maraleucel;liso-cel)是一款靶向CD19的CAR-T细胞疗法,具有4-1BB共刺激结构域,可增强CAR-T细胞的扩增和持久性。这款疗法的独特之处在于CAR-T疗法中CD8阳性和CD4阳性T细胞的比例得到控制,从而可以更好地控制细胞疗法的毒副作用。2021年2月,Breyanzi首次在美国获批上市,用于治疗接受过两种或多种系统治疗的复发或难治性大B细胞淋巴瘤(LBCL)成人患者,包括未另有说明的弥漫性大B细胞淋巴瘤(DLBCL)、高级别B细胞淋巴瘤、原发性纵隔大B细胞淋巴瘤和3B级FL。今年1月底,Breyanzi用于治疗接受过BTK抑制剂治疗的复发或难治性滤泡性淋巴瘤(FL)和套细胞淋巴瘤(MCL)成年患者的两项补充生物制品许可申请(sBLA)已获FDA受理和优先审评,PDUFA日期分别为2024年5月23日和2024年5月31日。
Breyanzi的获批是基于TRANSCEND NHL 001试验的MCL队列结果。在接受Breyanzi治疗并进行疗效评估的患者(n=68)中,根据2014 Lugano分类标准以及骨髓活检确认,85.3%的患者达成缓解(95% CI:74.6-92.7),其中67.6%的患者达到完全缓解(95% CI:55.2-78.5)。患者的缓解迅速且持久,中位达缓解时间为1个月(范围:0.7-3),中位缓解持续时间为13.3个月(95% CI:6.0-23.3),中位随访时间为22.2个月(95% CI:16.7-22.8)。超过一半(51.4%;95% CI:37.5-63.7)的缓解者在12个月时仍保持缓解,38.8%(95% CI:25-52.4)的缓解者在18个月时仍保持缓解。Breyanzi在各项临床试验(n=702)中表现出一致的安全性特征,54%的患者发生了任何级别的细胞因子释放综合征(CRS),其中3.2%的患者发生了>3级的CRS。
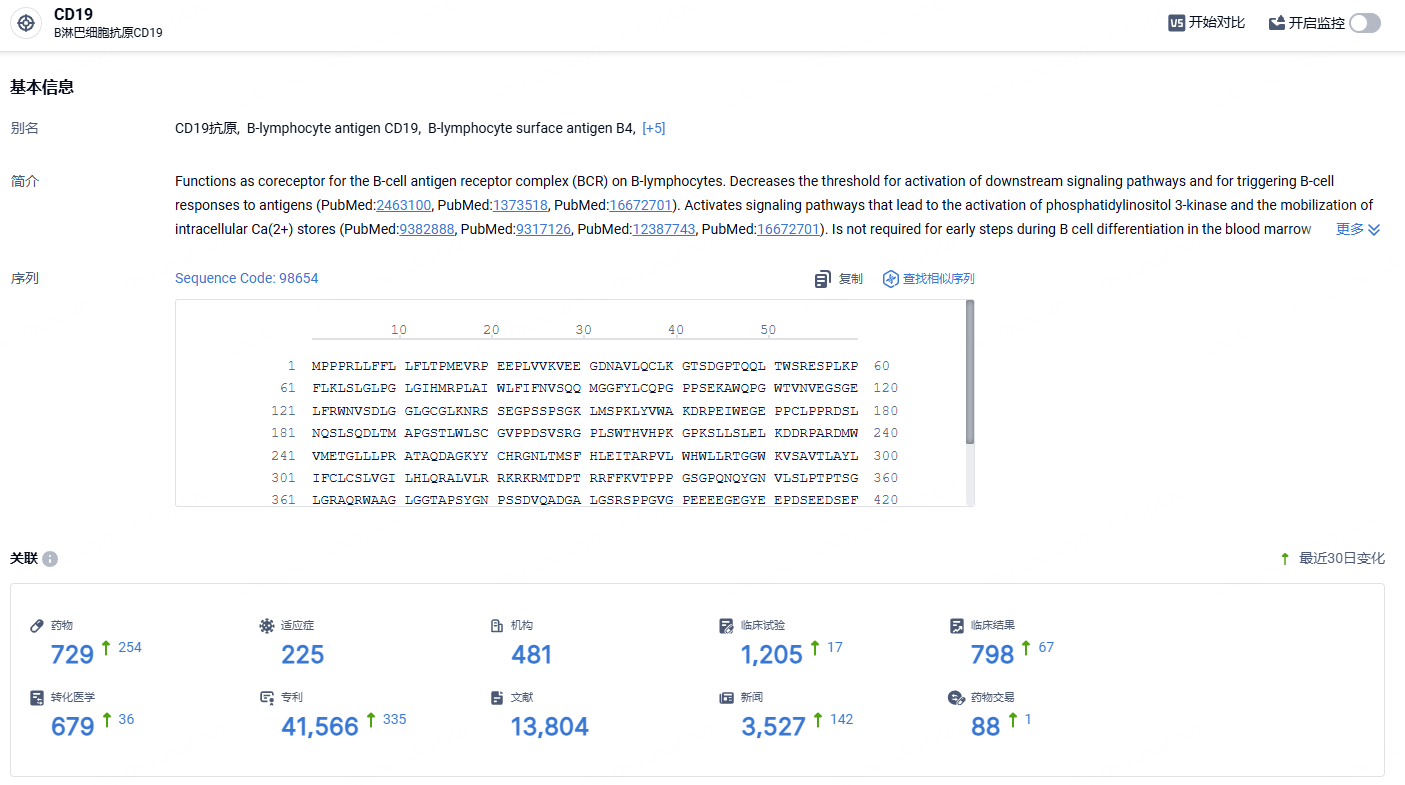
根据智慧芽新药情报库所披露的信息(点击下方图片直达CD19靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年6月1日,CD19靶点共有在研药物729个,包含的适应症有225种,在研机构481家,涉及相关的临床试验1205件,专利多达41566件……Breyanzi在2023年销售收入3.64亿美元,未来商业化可期。期待该药早日在国内获批,为国内患者带来新的治疗选择。