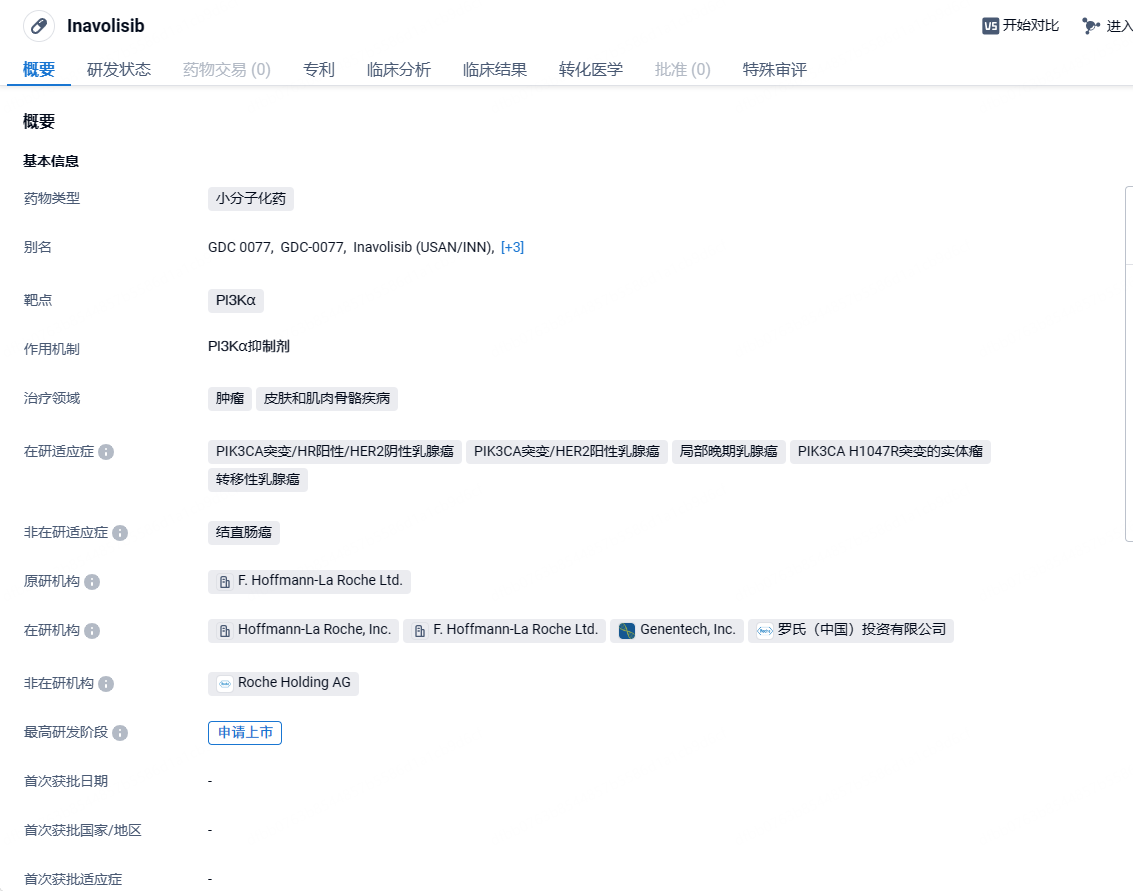
罗氏PI3Kα抑制剂Inavolisib在美申报上市并获优先审评,针对乳腺癌
2024年5月29日,罗氏宣布其PI3Kα抑制剂Inavolisib(GDC-0077)的新药申请(NDA)已被FDA受理并获优先审评资格,用于联合哌柏西利和氟维司群治疗既往接受内分泌疗法辅助治疗后或完成辅助内分泌治疗后12个月内复发的PIK3CA突变、激素受体阳性(HR+)、人表皮生长因子受体2阴性(HER2-)的局部晚期或转移性乳腺癌成人患者,PDUFA日期定为2024年11月27日。上个月,该适应症也获得了国家药监局的优先审评资格。
Inavolisib是一种具有同类最佳潜力的研究性口服靶向治疗药物,可为激素受体(HR)阳性、pik3ca突变的乳腺癌患者提供耐受性良好、持久的疾病控制,并可能改善预后,pik3ca突变是一种常见但经常被忽视的突变,约占该人群的40%Inavolisib被设计用于帮助最小化治疗的总体毒性,并且由于其对PI3Kα (PI3Kα)异构体抑制的高体外效力和特异性,以及其独特的作用机制,可导致突变PI3Kα的特异性降解,因此与其他PI3K抑制剂不同。2024年4 月 8 日,据 CDE 官网显示,拟将罗氏 GDC-0077(inavolisib)纳入优先审评,与哌柏西利和内分泌疗法联合用药适用于治疗 PIK3CA 突变、激素受体(HR)阳性、人表皮生长因子受体 2(HER2)阴性、局部晚期或转移性乳腺癌成人患者。
Inavolisib目前正在罗氏赞助的3项III期临床研究中进行研究,用于治疗pik3ca突变的局部晚期或转移性乳腺癌:帕博西尼联合氟维司汀与帕博西尼联合氟维司汀治疗一线hr阳性her2阴性乳腺癌(INAVO 120);在hr阳性her2阴性乳腺癌cdk4/6抑制剂和内分泌联合治疗(INAVO 121)后,联合使用氟维司汀vs.alpelisib+氟维司汀;帕妥珠单抗联合曲妥珠单抗皮下注射(Phesgo®)vs.Phesgo作为1Lher2阳性乳腺癌的维持治疗(INAVO 122)。
去年 12 月,罗氏宣布 III 期临床试验 INAVO120 研究取得阳性结果。试验结果显示,与Ibrance和氟维司群联用的对照组相比,inavolisib组合疗法将疾病进展或死亡风险降低57%。该公司计划将这一结果递交给监管机构,目标是尽快为患者提供这一潜在治疗方案。试验结果显示,inavolisib组合疗法组的无进展生存期(PFS)为15.0个月,对照组为7.3个月(HR=0.43,95% CI:0.32-0.59,p<0.0001)。Inavolisib联合疗法的耐受性良好,不良事件与此前研究的已知安全性特征一致,未观察到新的安全信号。
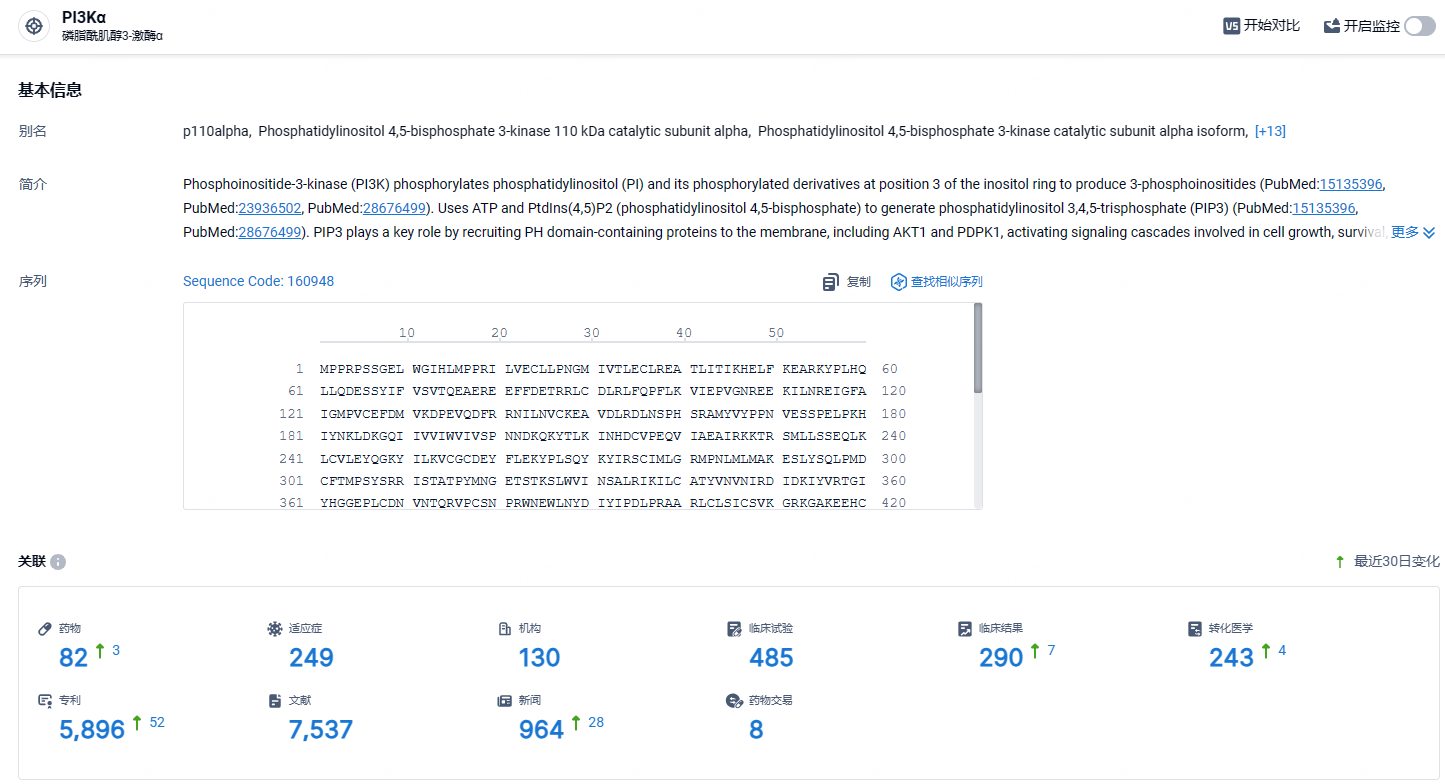
根据智慧芽新药情报库所披露的信息(点击下方图片直达PI3Kα靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2023年5月30日,PI3Kα靶点共有在研药物82个,包含的适应症有249种,在研机构130家,涉及相关的临床试验485件,专利多达5896件……罗氏的Inavolisib在III期研究中获得积极结果是PI3K抑制剂传来的久违的好消息。此次在美申报上市并获优先审评,期待Inavolisib早日获批上市为患者带来新的治疗选择。