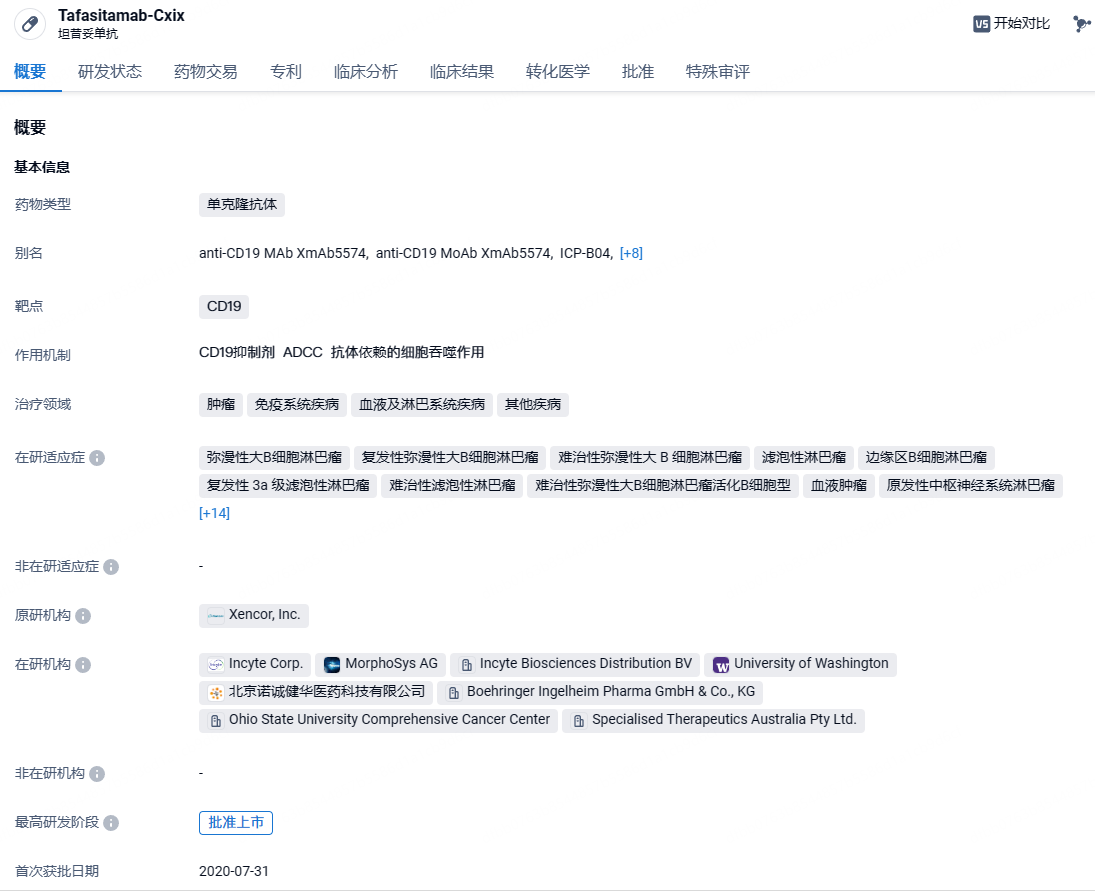
诺诚健华CD19单抗坦昔妥单抗申报上市,治疗弥漫性大B细胞淋巴瘤
2024年6月21日,中国国家药监局药品审评中心(CDE)官网公示,坦昔妥单抗(tafasitamab)上市申请已获受理。这是诺诚健华研发管线中的一款CD19单抗,本次申报上市的适应症为联合来那度胺治疗不适合自体干细胞移植条件的复发/难治弥漫性大B细胞淋巴瘤(DLBCL)成人患者。该上市申请此前已经被CDE纳入优先审评。
坦昔妥单抗(Tafasitamab)是一款靶向CD19的人源化单克隆抗体。2010年,MorphoSys公司从Xencor公司获得全球独家开发和商业化坦昔妥单抗的权利。坦昔妥单抗包含Xencor公司独有的XmAb®工程化Fc结构域,因此显著强化了抗体依赖性细胞介导的细胞毒作用(ADCC)和抗体依赖性细胞吞噬作用(ADCP),通过细胞凋亡和免疫效应机制介导 B 细胞肿瘤的裂解。2020年1月,MorphoSys和Incyte签署了在全球开发和商业化坦昔妥单抗的合作及许可协议。2024年2月,双方达成新协议,Incyte 获得在全球范围内开发和商业化坦昔妥单抗的独家权利。2021年8月,诺诚健华和Incyte就坦昔妥单抗在大中华区的血液瘤和实体瘤开发和独家商业化签订了合作和许可协议。在美国,Monjuvi® (tafasitamab-cxix) 被美国食品药品监督管理局加速批准与来那度胺联合治疗复发/难治性弥漫性大B 细胞淋巴瘤 (DLBCL) 成人患者(未明确指定),包括由低恶性淋巴瘤演进而来的 DLBCL ,以及不适合自体干细胞移植条件的患者。在欧洲,Minjuvi® (tafasitamab) 与来那度胺联合,之后是Minjuvi的单药治疗,已获欧洲药品管理局有条件批准用于治疗不符合自体干细胞移植条件的复发/难治性弥漫性大B细胞淋巴瘤的成人患者。
五年随访数据显示,坦昔妥单抗联合来那度胺,之后坦昔妥单抗单药治疗,为复发/难治性DLBCL成人患者提供长期且持久的缓解;Haematologica杂志上更新的该研究的5年随访数据显示:Tafasitamab联合来那度胺治疗R/R DLBCL的客观缓解率(ORR)达57.5%,完全缓解(CR)率达41.3%,未出现新的安全性事件。
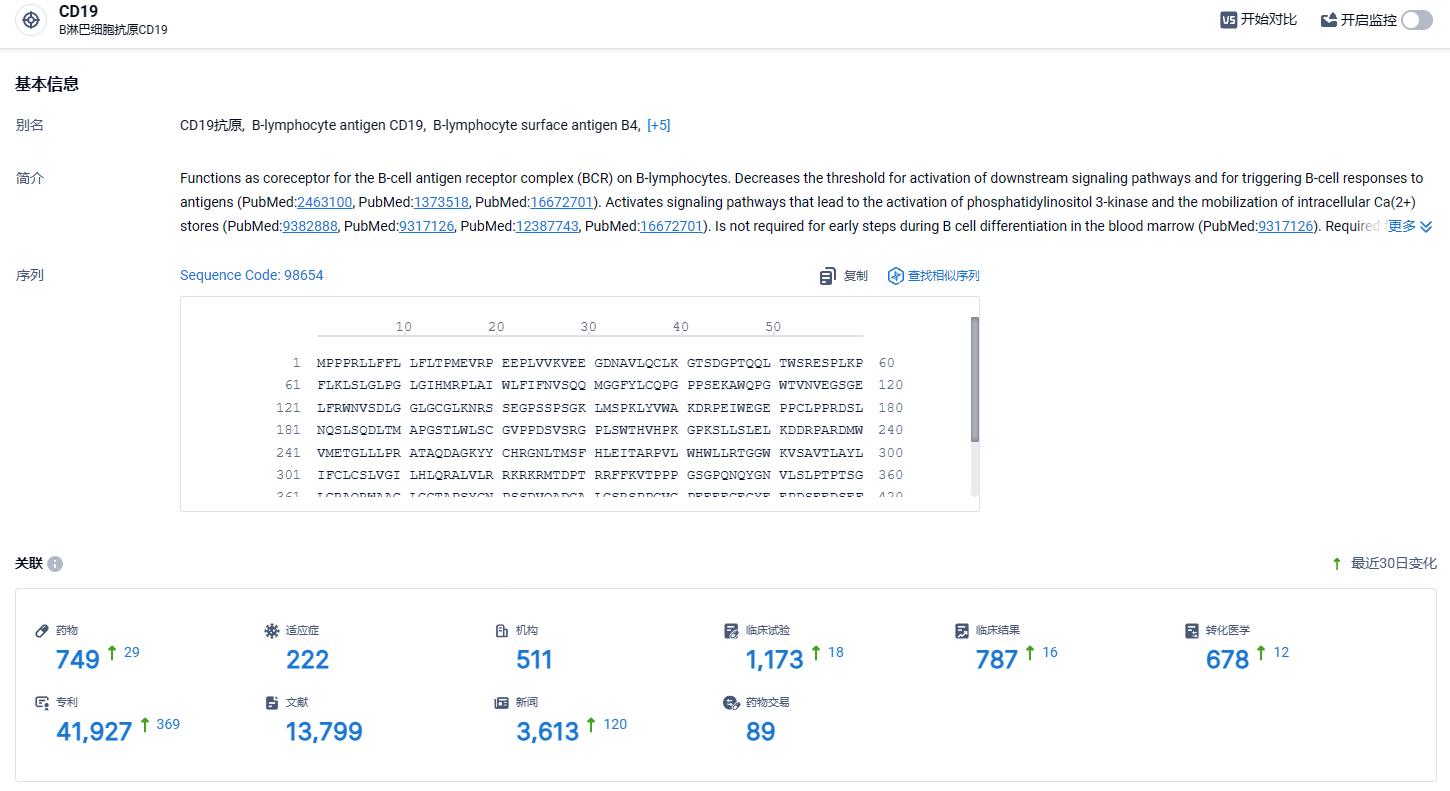
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CD19 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年6月22日,CD19靶点共有在研药物84个,包含的适应症有296种,在研机构151家,涉及相关的临床试验414件,专利多达28958件……据统计,在2022年、2023年,坦昔妥单抗在美国的销售额约为85百万美元和92百万美元。期待坦昔妥单抗能早日在国内获批上市,给患者带来新的治疗选择。