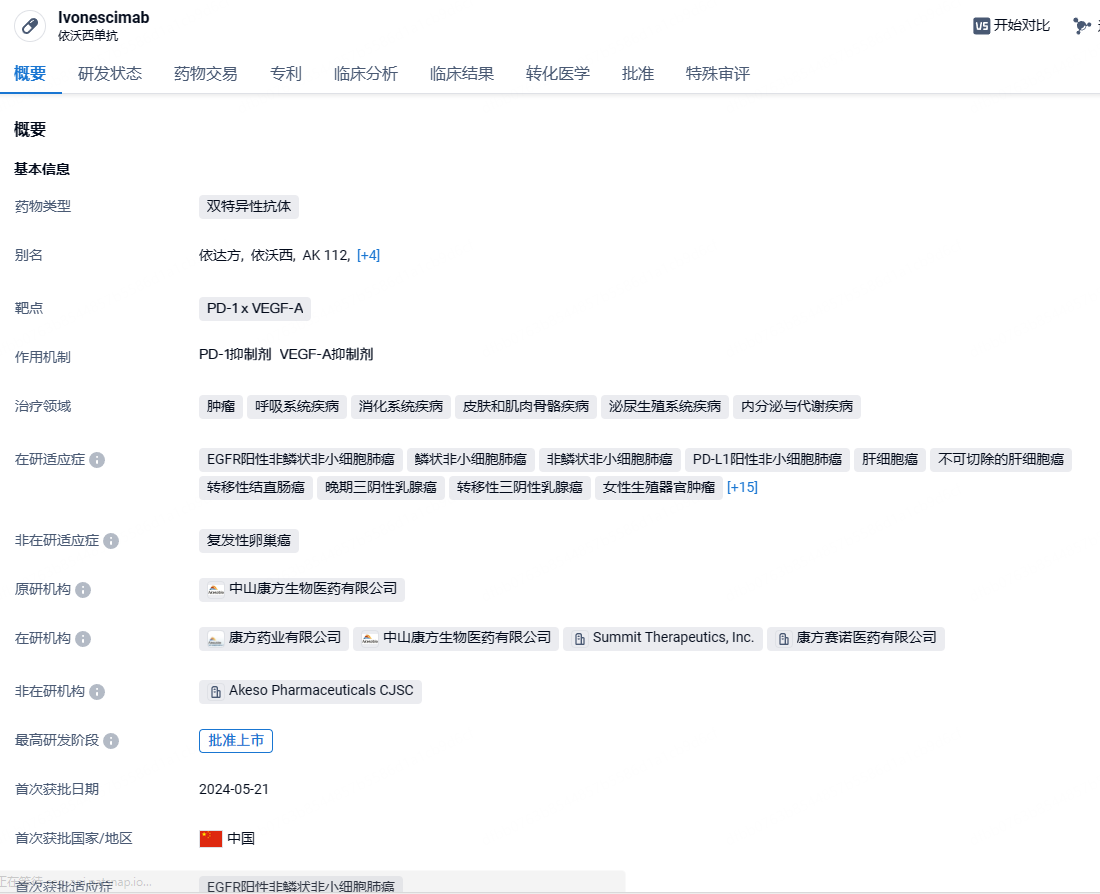
康方生物PD-1/VEGF双特异性抗体依沃西新适应症申请上市,针对非小细胞肺癌
7月29日,康方生物宣布,PD-1/VEGF双特异性抗体依沃西新适应症上市申请已经获得NMPA受理,本次申报上市的新适应症为:单药一线治疗PD-L1表达阳性(PD-L1 TPS≥1%)的局部晚期或转移性非小细胞肺癌(NSCLC)。
依沃西单抗是康方生物自主研发的全球首创PD-1 x VEGF-A双特异性抗体,处于全球临床开发进度最快。基于康方生物独特的Tetrabody技术设计,依沃西可阻断PD-1与PD-L1和PD-L2的结合,并同时阻断VEGF与VEGF受体的结合。鉴于VEGF和PD-1在肿瘤微环境中的共表达,与联合疗法相比,AK112作为单一药物同时阻断这两个靶点,可能会更有效地阻断这两个通路,从而增强抗肿瘤活性。2022年12月6日,康方生物与Summit签订合作协议,后者以可能高达50亿美元的总交易额(其中包括5亿美元首付款)获得依沃西单抗在美国、加拿大、欧洲和日本的开发和商业化权益。康方生物则保留该产品在以上地区之外的开发和商业化权益。同时,康方生物在Summit的协议许可地区拥有该产品的联名品牌权益。2023年8月1日,中国国家药监局药品审评中心(CDE)官网最新公示,康方生物PD-1/VEGF双抗依沃西单抗已递交新药上市申请并获得受理。此前,依沃西单抗曾先后3次被CDE纳入突破性治疗品种,其中包括已申报上市并在此次拟纳入优先审评的适应症。2023年8月24日,中国国家药监局药品审评中心(CDE)官网公示,康方生物旗下依沃西单抗(AK112,PD-1 x VEGF-A双抗)递交的新药上市申请(NDA)拟纳入优先审评,针对适应症为:联合培美曲塞和卡铂用于经EGFR酪氨酸激酶抑制剂(EGFR-TKI)治疗后进展的EGFR突变的局部晚期或转移性非鳞非小细胞肺癌(NSCLC)的治疗。2024年5 月 24 日,据 NMPA 官网显示,康方生物的依沃西单抗(AK112/Ivonescimab)国内获批上市,联合培美曲塞和卡铂用于经 EGFR 酪氨酸激酶抑制剂(EGFR-TKI)治疗后进展的 EGFR 突变的局部晚期或转移性非鳞 NSCLC 的治疗(受理号:CXSS2300061),成为全球首个肿瘤免疫+抗血管机制的双抗新药。据悉,依沃西单抗100mg(10ml)/瓶规格的定价为2299元/瓶。
此次依沃西新适应症上市申请是基于HARMONi-2(AK112-303)研究积极结果,在意向治疗人群(ITT)中,依沃西单抗单药相较于帕博利珠单抗单药显著延长了患者无进展生存期(PFS),风险比(HR)显著优于预期。这是全球首个在单药头对头III期临床研究中证明疗效显著优于帕博利珠单抗的药物。
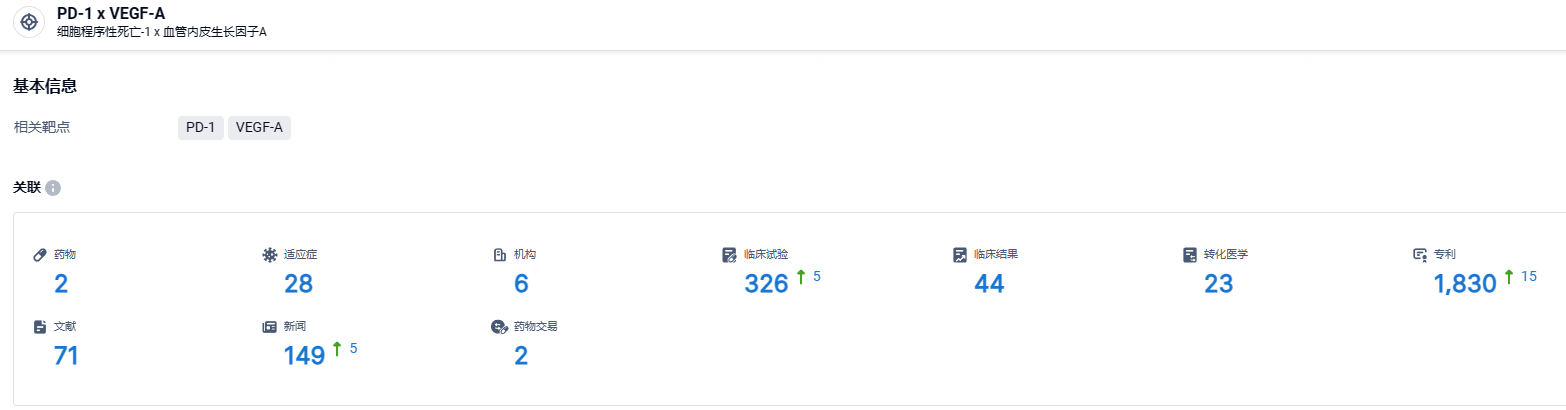
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PD-1 x VEGF-A靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年7月30日,PD-1 x VEGF-A靶点共有在研药物2个,包含的适应症有28种,在研机构6家,涉及相关的临床试验326件,专利多达1830件……2020 年世界新发肺癌病人数超 220 万,中国新发病人数超过 81 万,依沃西单抗已经展现出不俗的治疗肺癌潜力,该药有望为庞大的患者群体带来新的治疗选择。