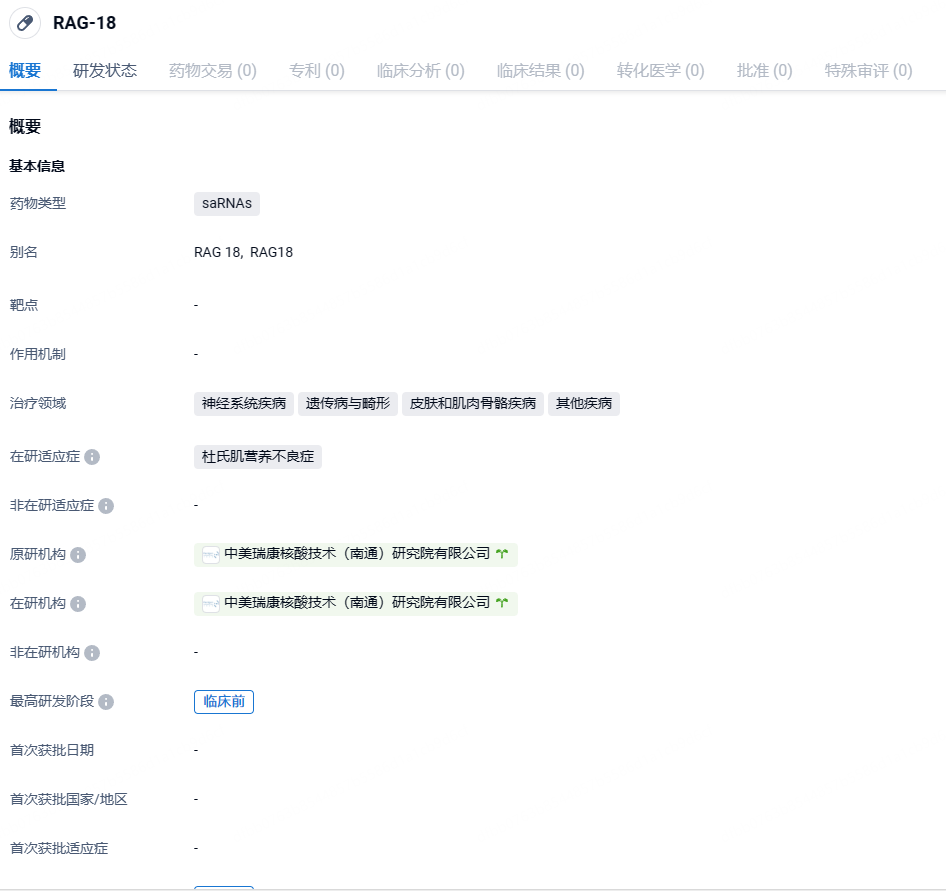
中美瑞康小核酸(saRNA)新药RAG-18获FDA儿科罕见病药物资格,治疗DMD
7月25日,中美瑞康(Ractigen Therapeutics)宣布其自主研发的小激活RNA (saRNA)药物RAG-18获得美国FDA的儿科罕见病药物资格(RPDD)。
RAG-18是一种创新型治疗策略,正在开发用于治疗由任何DMD基因突变引起的杜氏肌营养不良(DMD)和贝氏肌营养不良(BMD)。RNA激活(RNAa)技术利用靶向基因启动子区域的双链RNA来激活基因表达,以恢复治疗性蛋白的水平。RNA激活技术在开发治疗性药物方面具有广阔的应用前景,包括肿瘤、遗传性疾病、慢性疾病、代谢性疾病、心脑血管疾病等。
中美瑞康致力于开发突破性小核酸药物,并基于RNA激活技术建立了多款小核酸药物管线。中美瑞康已经有2款创新小核酸药物处于临床开发阶段,分别为小激活RNA(saRNA)药物RAG-01以及双链小干扰RNA药物RAG-17。RAG-18是中美瑞康开发的另一款创新作用机制的双链saRNA药物,通过RNA激活(RNAa)机制特异性靶向激活肌肉细胞中UTRN基因表达。由UTRN基因编码的肌营养不良蛋白(utrophin)在结构和功能上与抗肌萎缩蛋白(dystrophin)相似,它的上调可以功能性替代 DMD 肌肉细胞中缺失的抗肌萎缩蛋白,从而治疗所有突变类型的DMD和BMD患者。临床前研究表明,采用中美瑞康自主开发的小核酸递送系统LiCO™并通过皮下注射,RAG-18能够显著减轻DMD模型小鼠的肌肉损伤,显示出在治疗DMD患者方面的潜力。
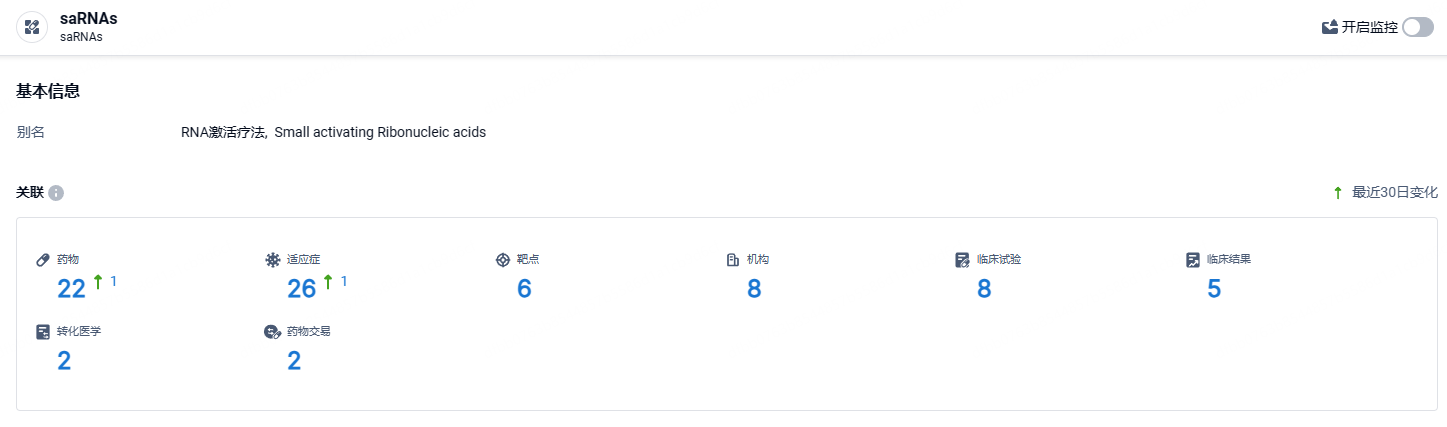
根据智慧芽新药情报库所披露的信息 (点击下方图片直达saRNA药物类型注册登录后可免费获得该药物类型下的在研药物、适应症、靶点、研发机构、临床试验等详细信息),截止到 2024 年7月28日,saRNA这一药物类型共有在研药物22个,包含的适应症有26种,靶点6个,在研机构8家,涉及相关的临床试验8件……罕见儿科疾病认定(RPDD)是FDA针对美国患者人数少于20万且严重危及18岁以下儿童生命的儿科罕见病药物资格认定,旨在鼓励开发和批准针对罕见儿科疾病的治疗方法。期待RAG-18后续研发能够顺利。