传奇生物CAR-T疗法西达基奥仑赛获FDA推荐用于多发性骨髓瘤早期治疗
2024年3月15日,FDA ODAC(肿瘤药物咨询委员会)会议中专家组以11票赞同,0票反对的结果,认为强生&传奇生物的Carvykti(西达基奥仑赛,cilta-cel)用于既往至少接受过1线治疗(包括蛋白酶体抑制剂和免疫调节剂且来那度胺难治)的复发性和来那度胺难治性多发性骨髓瘤(R/R MM)成人患者具有有利的获益-风险结果。目前,由CARTITUDE-4研究支持的补充生物制品许可申请(sBLA)正在接受FDA审查,PDUFA日期为2024年4月5日。
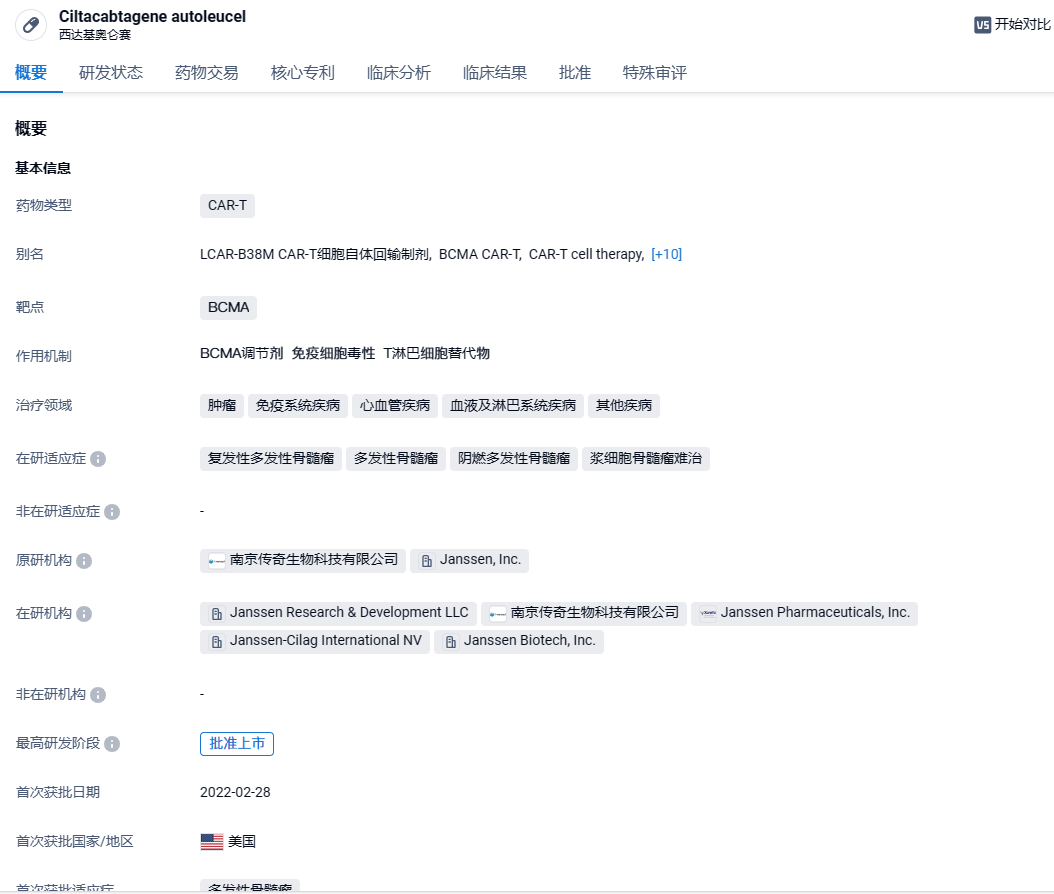
西达基奥仑赛是由传奇生物开发的一款靶向BCMA的嵌合抗原受体T细胞(CAR-T)疗法,使用CAR的转基因对患者自身的T细胞进行修饰,以识别和消除表达BCMA的细胞。BCMA主要表达于恶性多发性骨髓瘤B系细胞、晚期B细胞和浆细胞表面。西达基奥仑赛的CAR蛋白具有两种BCMA靶向单域抗体,对表达BCMA的细胞具有高亲和力,在与BCMA表达细胞结合后,CAR可促进T细胞活化、扩增,继而清除靶细胞。2017年12月,杨森与传奇生物签订了全球独家许可和合作协议,以开发和商业化该产品。2022年2月,西达基奥仑赛获得美国FDA批准,用于治疗复发或难治性多发性骨髓瘤成人患者;2022年5月和9月,该药又先后获得欧盟委员会(EC)和日本厚生劳动省(MHLW)批准上市。在中国,西达基奥仑赛已递交新药上市申请,并被纳入优先审评和突破性治疗品种。
III期CARTITUDE-4研究(NCT04181827)中,既往接受1-3线治疗且来那度胺难治的R/R MM患者随机接受cilta-cel(n=208)或医生选择方案(n=211)。结果显示,cilta-cel组mPFS显著改善(NR vs 11.8个月,HR=0.41,95%CI 0.30-0.56,p<0.0001),达到主要终点;关键次要终点ORR同样显示获益(85% vs 68%,p<0.0001),不过FDA注意到cilta-cel组死亡导致的PFS事件比例更高(8% vs 2%)。目前,中期OS数据尚不成熟(34% information fraction),两组中位OS分别为未达到和26.7个月(HR 0.78,95%CI 0.51-1.20)。两组的OS Kaplan-Meier曲线在~11个月时交叉,即前~11个月中cilta-cel组具有更低的OS。安全性方面,cilta-cel与既往报道结果基本一致。FDA指出此次ODAC会议讨论的关键议题为:cilta-cel组早期死亡率增加。对ITT人群,在随机化后前10个月,cilta-cel组的死亡率相比标准治疗组更高(14% vs 12%),其中AE导致的死亡比例分别为7.7%和4.7%。
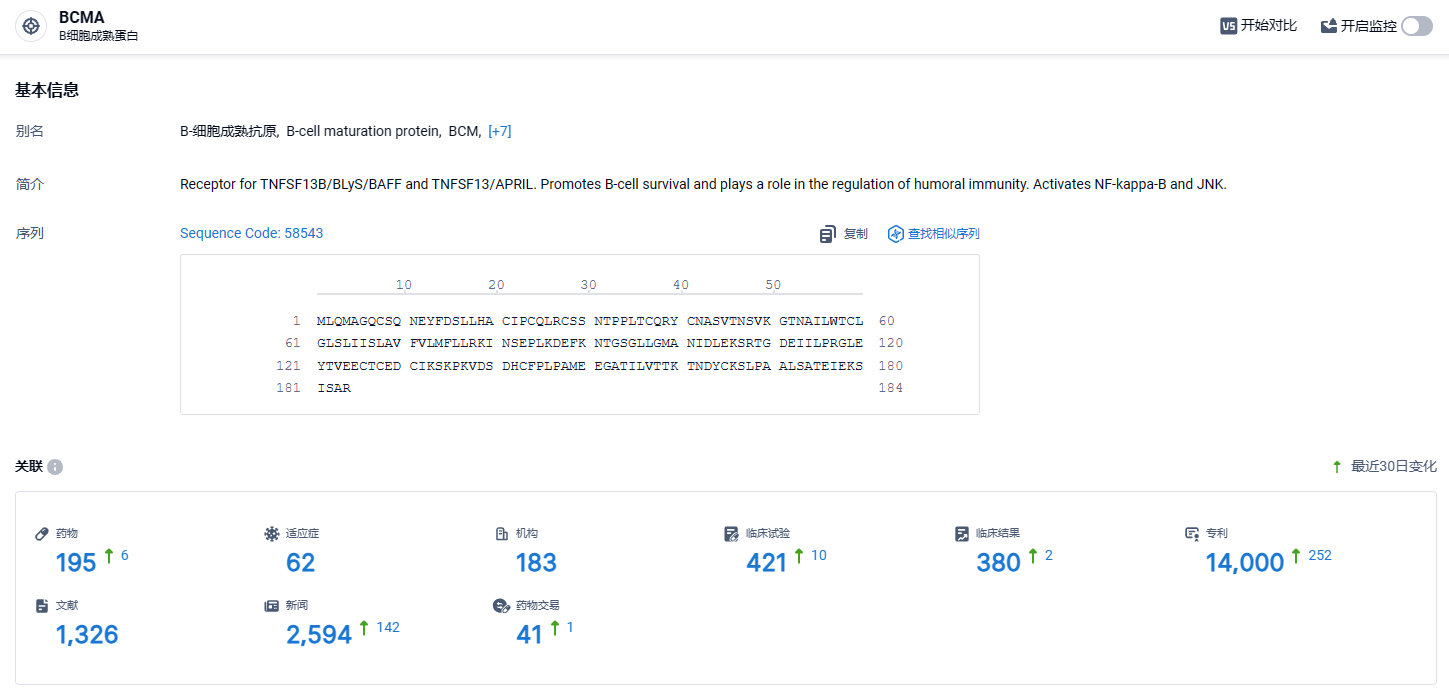
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达BCMA靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年3月19日,BCMA靶点共有在研药物195个,包含的适应症有62种,在研机构183家,涉及相关的临床试验421件,专利多达14000件……CAR-T细胞疗法的出现对于血液肿瘤治疗具有革命性意义,为血液肿瘤患者带来了新的治疗选择和希望,尤其用于后线骨髓瘤患者可显著提高缓解率并延长生存期,改善了患者治疗效果和生存质量。期待西达基奥仑赛商业化一切顺利。