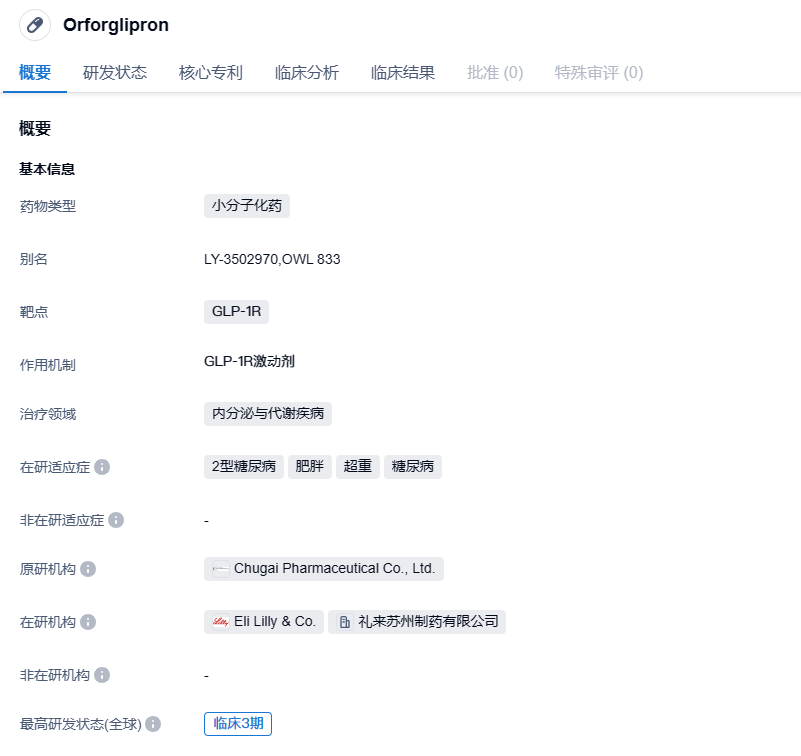
礼来启动GLP-1R激动剂Orforglipron中国III期临床,治疗肥胖或超重
2023年9月6日,药物临床试验信息公示与登记平台官网显示,礼来登记了一项口服小分子GLP-1R激动剂Orforglipron(LY3502970)治疗合并肥胖或超重的2型糖尿病患者的III期临床试验(研究代号:ATTAIN-2)。
礼来开发的研究性口服降糖药物(Orforglipron)是一种 GLP-1 受体激动剂,与诺和诺德的司美格鲁肽注射液属于相同靶点,其作用机制也是激活血糖调节、减缓胃排空以及降低食欲等。不同的是,前者是小分子药物,可以口服给药,而后者是多肽药物,需要注射给药。
Orforglipron支持口服一天一次给药,最早由中外制药研发,2018年,礼来与中外制药达成合作,以5000万美元首付款获得Orforglipron的全球开发和商业化权益。Orforglipron在降糖和减重领域均有巨大的潜力,礼来正在积极推进该药在糖尿病和减重两个适应症的临床进度。
目前,礼来已启动了多项Orforglipron的III期临床研究,以进一步研究对肥胖和超重(ATTAIN系列研究)以及2型糖尿病(ACHIEVE系列研究)的治疗效果和安全性。ATTAIN-1研究是一项全球性的III期研究,旨在评估每日1次口服Orforglipron在伴有肥胖相关合并症的成人肥胖或超重患者中的疗效和安全性,目标入组3000例患者。ATTAIN-2研究是一项全球性的III期研究,旨在评估每日1次口服Orforglipron在伴有2型糖尿病的肥胖或超重成人患者中的疗效与安全性。该研究拟纳入1500例BMI≥27kg/m2的2型糖尿病(HbA1c:7%~10%)成人患者,这些患者有至少一次饮食减肥失败经历。ATTAIN-J研究是一项在日本开展的III期研究,旨在评估每日1次口服Orforglipron在伴有肥胖相关并发症的成人肥胖患者中的疗效与安全性。
2023年6月23日,礼来公布了首款非肽口服胰高血糖素样肽-1(GLP-1)受体激动剂orforglipron的最新II期数据,该研究正在评估orforglipron用于肥胖或超重患者的慢性体重管理。该研究结果在美国糖尿病协会第83届科学会议上以口头报告形式分享,并同时发表在《新英格兰医学杂志》上。第26周的主要终点评估中,orforglipron组(12mg, 24mg, 36mg或45mg)在所有剂量下均显示出具有统计学意义的剂量依赖性体重减轻,减重范围为8.6%(19.8磅或9.0公斤)至12.6%(29.3磅或13.3公斤),而安慰剂组为2.0%(4.6磅或2.1公斤)。对于那些服用 orforglipron的受试者,体重在36周时持续下降,所有剂量的体重都有所减少,范围为9.4%(21.6磅或9.8公斤)至14.7%(34.0磅或15.4公斤),而安慰剂组的体重减少了2.3%(5.3磅或2.4公斤)。受试者的平均基线体重为240磅(109公斤)。orforglipron的安全性与其他以肠促胰岛素为基础的治疗相似。胃肠道副作用是最常报道的不良事件,严重程度一般为轻至中度,通常发生在剂量递增期间。
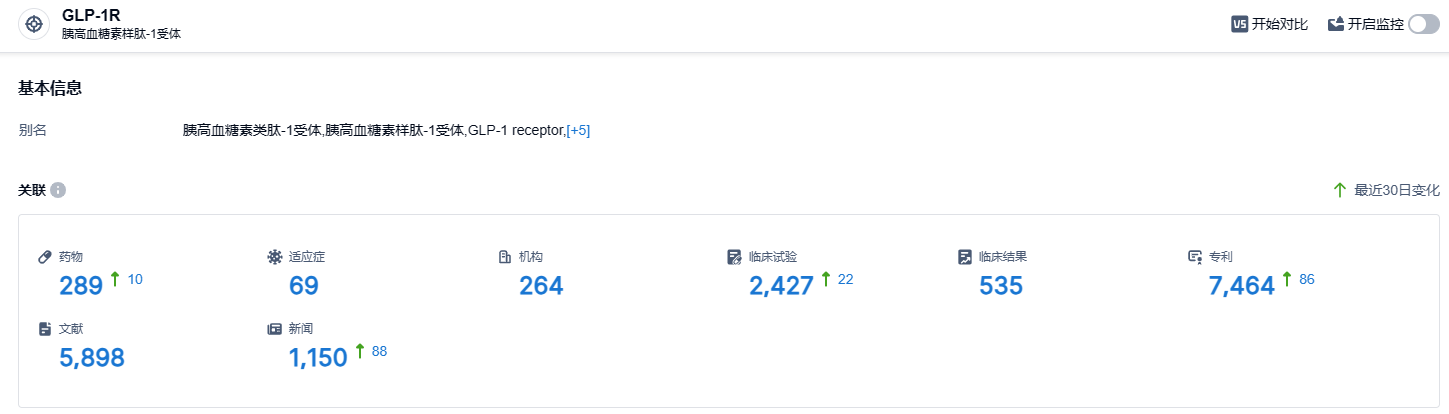
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 GLP-1R靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月8日,GLP-1R靶点共有在研药物289个,包含的适应症有69种,在研机构264家,涉及相关的临床试验2427件,专利多达7464件……GLP-1R单靶点或多靶点新药正在如火如荼的进行临床研究,红海市场初见端倪。