璎黎药业递交PI3Kδ抑制剂林普利塞新适应症上市申请,治疗外周T细胞淋巴瘤
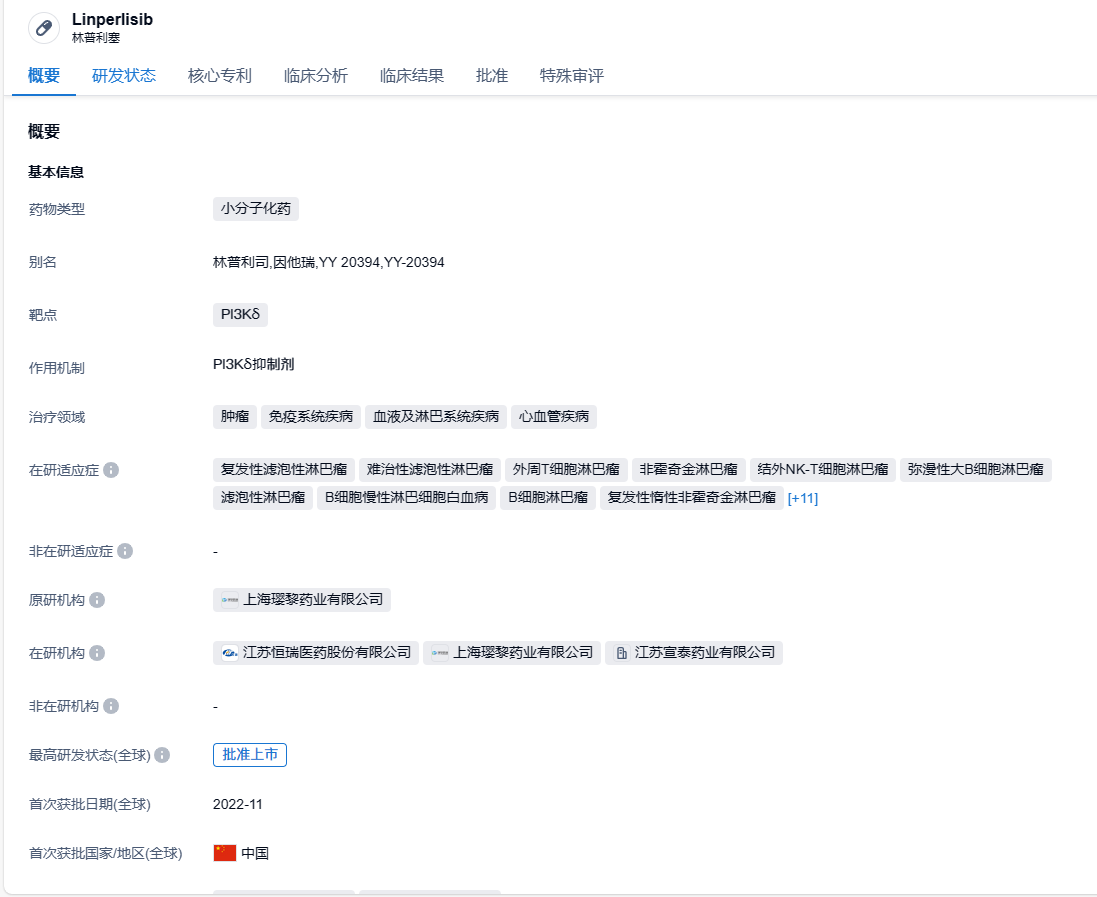
2023年9月6日,璎黎药业宣布,其PI3Kδ抑制剂林普利塞新适应症上市申请获中国国家药品监督管理局药品审评中心(CDE)受理,用于治疗复发和/或难治性外周T细胞淋巴瘤(R/R PTCL)患者。这是林普利塞第2项申报上市的适应症。
林普利塞是璎黎药业自主研发并拥有知识产权的1类创新药,是新一代磷脂酰肌醇3-激酶-δ(PI3Kδ)小分子抑制剂。2021年2月,恒瑞医药与璎黎药业签订战略合作协议,恒瑞医药将对璎黎药业进行2000万美金股权投资,璎黎药业授予恒瑞针对林普利司在大中华地区的联合开发权益以及排他性独家商业化权益。2022年11月9日,林普利塞片获国家药监局附条件批准上市,用于既往接受过至少两种系统性治疗的复发或难治滤泡性淋巴瘤成人患者。林普利塞片是我国首个本土企业自主研发的高选择性PI3Kδ抑制剂,该药采用创新性的药物结构,使其选择性更高、特异性更强,有助于减少高血糖、高血压及腹泻等不良反应情况的发生。
此前,林普利塞用于43例R/R PTCL患者的多中心、单臂、开放标签1b期研究结果已在2022年美国血液学会(ASH)年会中公布。研究结果显示,中位随访17个月时,总缓解率(ORR)达60%,完全缓解(CR)率为35%,疾病控制率(DCR)为84%,安全性良好。此次林普利塞递交的新适应症上市申请基于一项单臂、多中心2期注册性临床研究结果,试验旨在评估林普利塞治疗R/R PTCL的疗效和安全性。此研究的主要终点是由独立数据评估委员会(IRC)评估的总缓解率。初步数据显示,林普利塞治疗R/R PTCL疗效良好,安全性可控,有望成为R/R PTCL患者的治疗新选择。
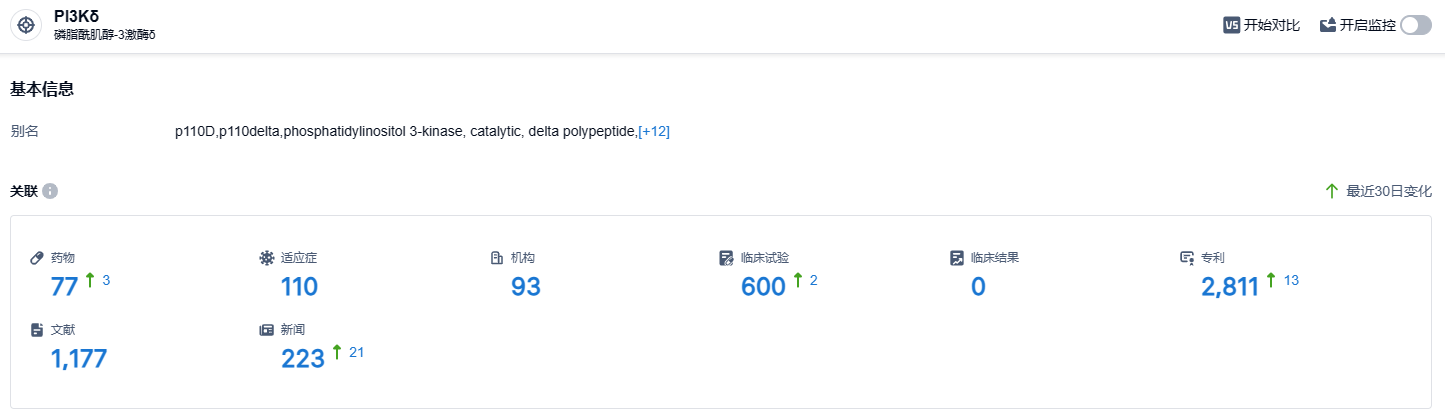
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 PI3Kδ 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月8日,PI3Kδ靶点共有在研药物77个,包含的适应症有110种,在研机构93家,涉及相关的临床试验600件,专利多达2811件……国内PI3Kδ小分子抑制剂竞争格局方面,除林普利塞外,石药集团从Verastem引进的度维利塞已于2022年3月获批上市,适应症为治疗既往至少经过两次系统治疗的复发或难治性(R/R)滤泡性淋巴瘤(FL);拜耳的可泮利塞也于2023年5月获批上市,适应症同样为R/R FL。值得注意的是,正大天晴在研的PI3Kδ抑制剂的TQB3525、信达生物从Incyte引进的PI3Kδ抑制剂帕萨利司(parsaclisib)也已经申报上市,未来该赛道的竞争将会更加激烈。