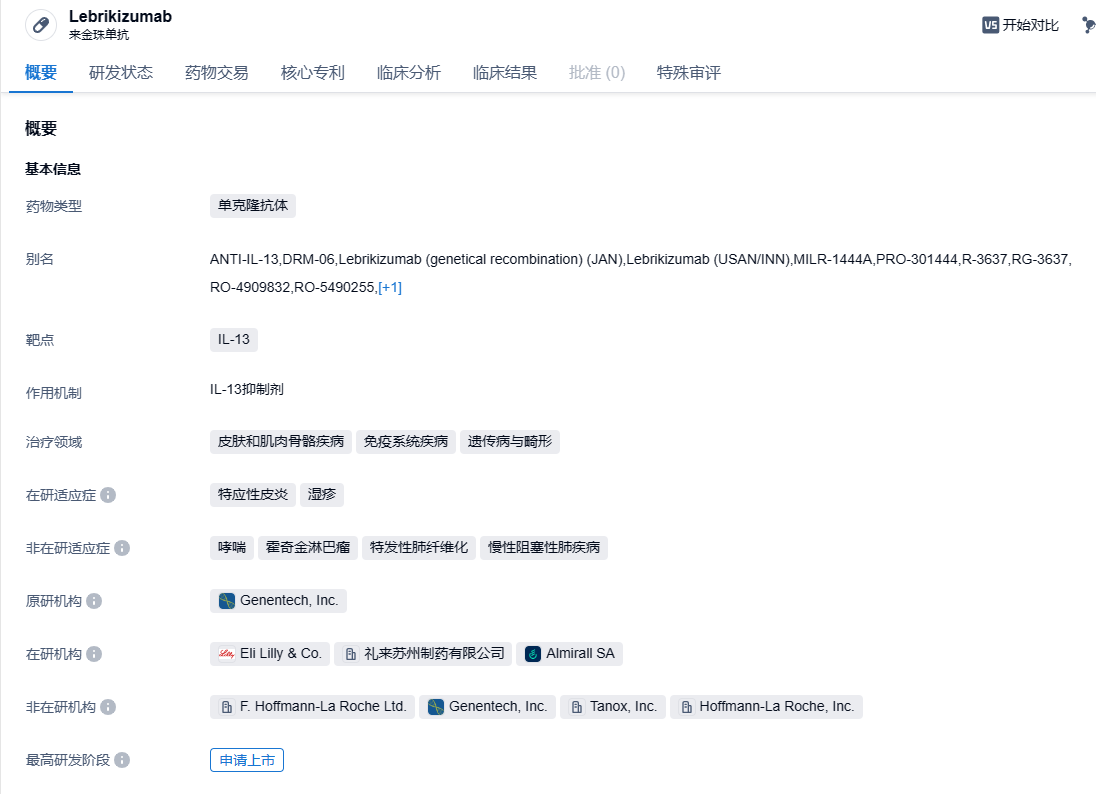
礼来IL-13抑制剂lebrikizumab显示长期疗效,针对中重度特应性皮炎
近日,礼来(Eli Lilly and Company)公布了其在研IL-13抑制剂lebrikizumab在中重度特应性皮炎患者中的长期疗效。结果表明,中重度特应性皮炎患者在为期两年的扩展试验中通过每月维持使用lebrikizumab,皮肤症状清除、瘙痒缓解和疾病严重程度降低等临床获益均得到保持。
Lebrikizumab是一种新型的抗IL-13单克隆抗体,具有生物利用度高和半衰期长的特点,能够高亲和力结合可溶性IL-13,阻断IL-13介导的信号通路。此前,Lebrikizumab曾获得FDA的快速通道资格。Lebrikizumab最初由Tanox开发,名称为TNX-650;2007年Genentech(罗氏子公司)收购Tanox,Lebrikizumab成为了罗氏管线中的一员。 紧接着,2017年Dermira支付罗氏8000万美元首付款、14亿美元里程碑总额,获得Lebrikizumab全球权益。2019年6月,该药的欧洲权益又被出售给Almirall。2020年1月,礼来以总价11亿美元收购了Dermira,Lebrikizumab欧洲以外的全球权益落入礼来手中。
ADjoin是一项为期两年的扩展试验,患者来自于lebrikizumab单药治疗试验ADvocate 1和ADvocate 2以及lebrikizumab与局部皮质类固醇联合治疗试验Adhere。这些患者在接受lebrikizumab治疗16周后的研究者总体评估反应(IGA)评分为0(清除)或1(几乎清除),或者平均湿疹面积和严重程度指数相对基线降低75%(EASI-75),就会被纳入ADjoin试验。参加长期扩展试验的患者每两周或每月需要接受250 mg的lebrikizumab。在ADjoin试验中,每月给药或每两周给药lebrikizumab持续两年,对患者的皮肤症状和瘙痒具有持久的疗效。
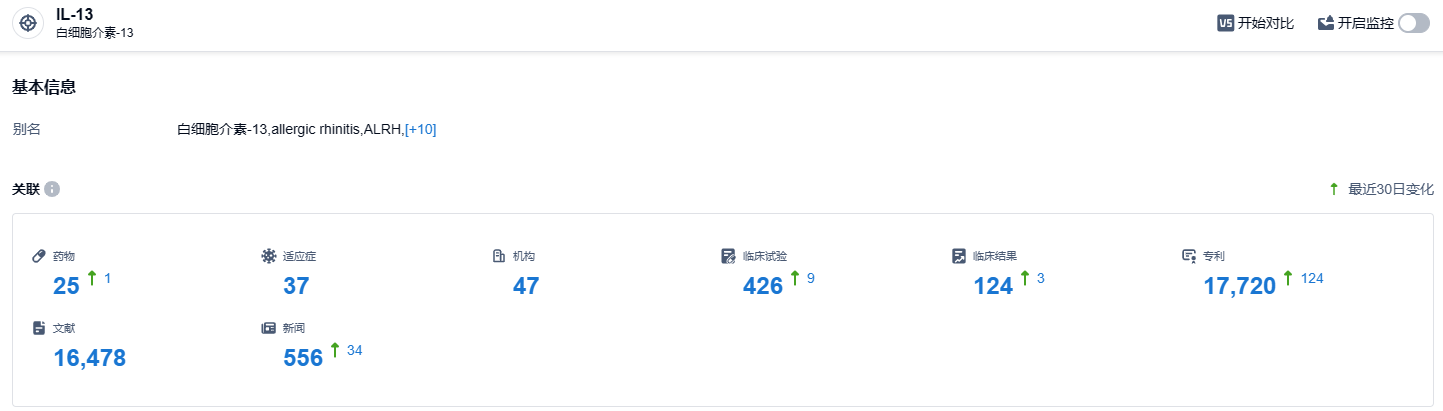
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-13靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月28日,IL-13 靶点共有在研药物25个,包含的适应症有37种,在研机构47家,涉及相关的临床试验426件,专利多达17720件……今年10月2日,FDA宣布拒绝批准礼来用于治疗中度至重度特应性皮炎(湿疹)的Lebrikizumab生物许可申请(BLA),主要原因是在检查中发现了第三方合同生产组织(CMO)的问题。 来自FDA的CRL中没有提到对Lebrikizumab的临床数据、安全性或标签的担忧,因此,如果CMO问题可以有效解决,或者生产转移到新的合作伙伴,等待批准时间或许不用太久。期待Lebrikizumab能够早日获批。