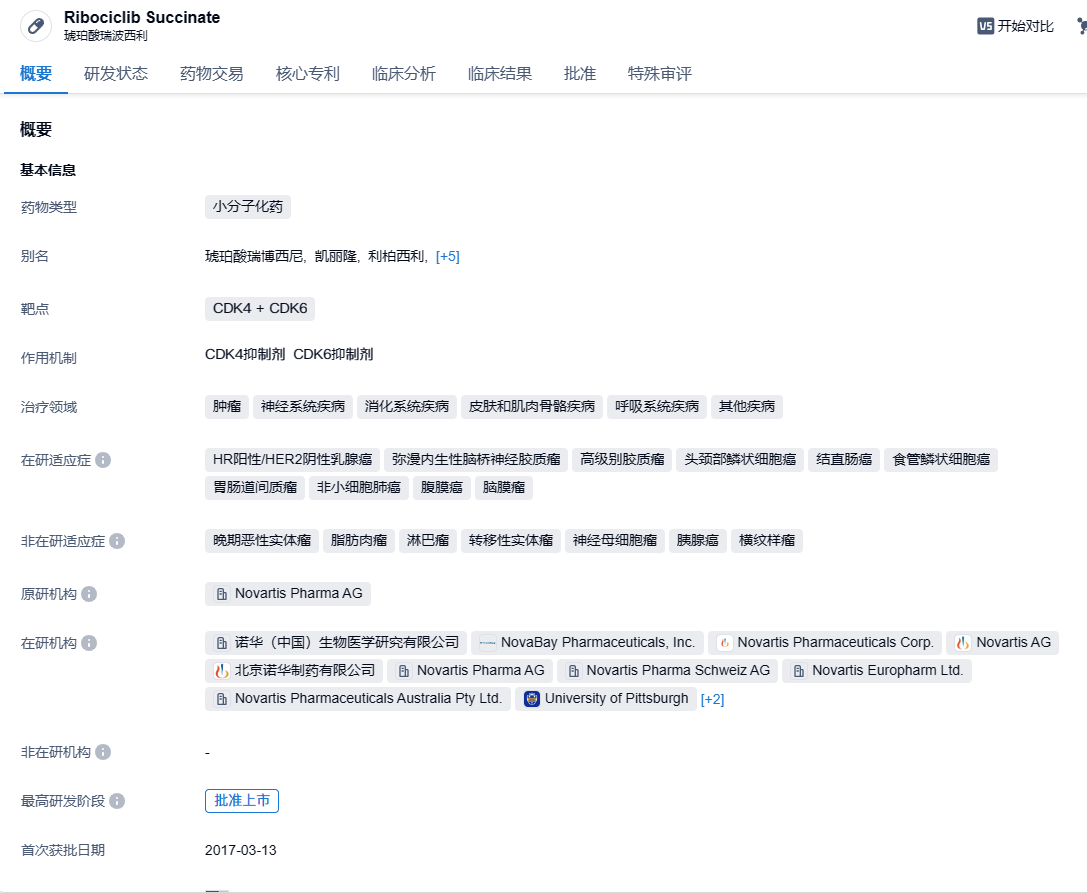
诺华CDK4/6抑制剂瑞波西利新适应症在华申报上市,治疗乳腺癌
2023年12月19日,CDE网站显示,诺华CDK4/6抑制剂瑞波西利新适应症上市申请获得药监局受理。推测本次申报适应症为:瑞波西利联合内分泌治疗(ET)用于HR+/HER2-早期乳腺癌患者辅助治疗。今年1月,瑞波西利首次在华获批上市,适应症为联合芳香化酶抑制剂(AI)一线治疗绝经前或围绝经期HR+/HER2-晚期乳腺癌;随后5月,瑞波西利获批适应症扩大至绝经后HR+/HER2-局部晚期或转移性乳腺癌,与AI联合用药作为女性患者的初始内分泌治疗,使得瑞波西利成为国内首个且目前唯一一款在晚期乳腺癌一线治疗领域覆盖绝经前/围绝经期、绝经后人群的CDK4/6抑制剂。
瑞波西利(ribociclib,Kisqali)是FDA批准的第二款CDK4 + CDK6抑制剂,2017年3月被FDA批准联合一种芳香酶抑制剂,作为一种初始内分泌疗法,用于HR+/HER2-局部晚期或转移性乳腺癌绝经后女性患者的一线治疗。随后,该药又被FDA批准用于治疗HR +/HER2-晚期或转移性女性乳腺癌患者,成为首款联合芳香酶抑制剂治疗绝经前、围绝经、绝经后女性患者的CDK4/6抑制剂。今年1月,瑞波西利首次在华获批上市,适应症为联合芳香化酶抑制剂(AI)一线治疗绝经前或围绝经期HR+/HER2-晚期乳腺癌;随后5月,瑞波西利获批适应症扩大至绝经后HR+/HER2-局部晚期或转移性乳腺癌,与AI联合用药作为女性患者的初始内分泌治疗,使得瑞波西利成为国内首个且目前唯一一款在晚期乳腺癌一线治疗领域覆盖绝经前/围绝经期、绝经后人群的CDK4/6抑制剂。
近期,诺华公布了瑞波西利联合内分泌治疗HR+/HER2-早期乳腺癌患者辅助治疗的III期NATALEE研究最新数据。结果显示,与单独应用ET相比,接受瑞波西利联合ET治疗的患者疾病复发风险降低了25.1% (HR=0.749; 95%CI:0.628, 0.892; p=0.0006) 。瑞波西利在所有次要疗效终点上的数据也是一致的,包括无远处转移生存期(DDFS,风险降低25.1%)和无复发生存期(RFS,风险降低27.3%)。两个治疗组的事件发生率均低于4%(瑞波西利联合治疗组为3.3%,仅ET治疗组为3.4%),因此从长远来看,总生存期(OS)结果将继续发展。
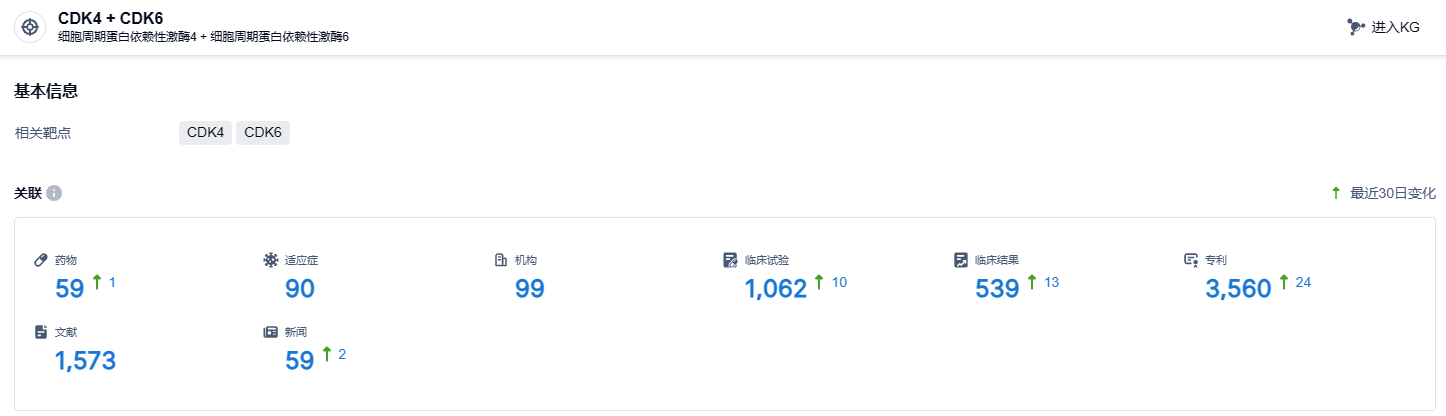
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达CDK4 + CDK6靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年12月20日,CDK4 + CDK6靶点共有在研药物59个,包含的适应症有90种,在研机构99家,涉及相关的临床试验1062件,专利多达3560件……目前,Kisqali 已在全球99个国家/地区获批上市,2020年至2022年其销售额分别为6.87亿美元、9.37亿美元、12.31亿美元,今年前三季度其销售额为14.7亿美元。瑞波西利的商业化之路正在开启