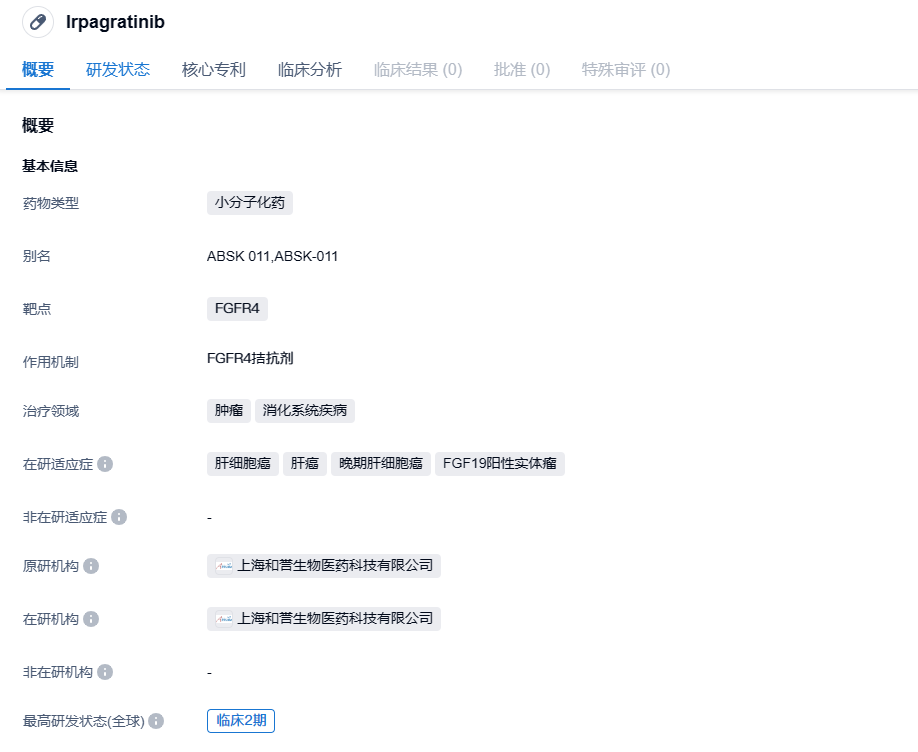
和誉医药FGFR4抑制剂irpagratinib在美国获批临床,治疗肝细胞癌
近日,和誉医药宣布其自主研发的高选择性小分子成纤维细胞生长因子受体4(FGFR4)抑制剂irpagratinib(ABSK011)取得两项进展:1)irpagratinib获美国FDA批准,可开展单药在晚期肝细胞癌(HCC)患者中的1期临床试验,这也是和誉医药在中国以外展开的首个irpagratinib的临床试验;2)irpagratinib联合仑伐替尼治疗晚期或不可切除HCC的2期临床试验申请(IND)获中国国家药监局(NMPA)批准。
Irpagratinib是一款具有高选择性的成纤维细胞生长因子受体 4(FGFR4)小分子抑制剂,拟用于治疗晚期实体瘤,尤其是存在 FGFR4信号通路异常(如配体FGF19扩增/过表达,FGFR4突变/扩增/融合等)的晚期HCC、胆管癌、乳腺癌等。FGFR4信号通路是HCC分子靶向治疗开发的一个很有前景的方向。与竞争性产品相比,Irpagratinib表现出了更好的效力和抗肿瘤疗效,并在临床前研究中具有良好的物理化学性质。
此次获批的研究是“一项开放的评价ABSK-011在晚期实体瘤患者中的安全性、耐受性与药代动力学I期临床研究”。研究人群主要为FGF19过表达肝细胞癌(Hepatocellular carcinoma, HCC)患者。这是和誉医药在中国以外展开的首个Irpagratinib临床试验。2022年12月,和誉医药公布了Irpagratinib在中国进行的针对FGF19过表达的二线肝细胞癌患者的I期初步结果,展现出优异的安全性及疗效。和誉医药还将在今年10月举行的2023年欧洲肿瘤学会(ESMO)年会上公布Irpagratinib在该I期临床试验中的进一步最新结果。与此同时,和誉医药还在中国内地对FGF19过表达的晚期HCC患者进行Irpagratinib联合抗PD-L1抗体阿替利珠单抗(罗氏制药研制)的II期试验,该试验已于2022年2月完成首例患者入组。
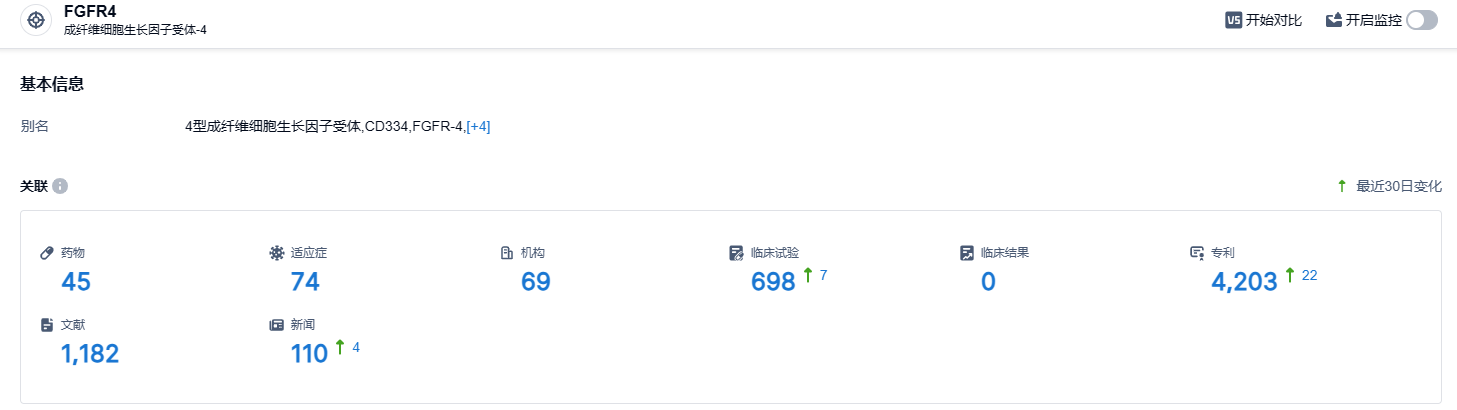
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 FGFR4 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月27日,FGFR4 靶点共有在研药物45个,包含的适应症有74种,在研机构69家,涉及相关的临床试验698件,专利多达4203件……据弗若斯特沙利文预测,中国和全球FGFR4药物市场在2025-2030年的复合年增长率分别为50.9%和60.1%,2026年中国和全球的FGFR4药物市场分别为2.08亿美元和5.55亿美元,2030年分别为7.40亿美元和24.35亿美元。期待Irpagratinib能够在FGFR4靶点赛道脱颖而出。