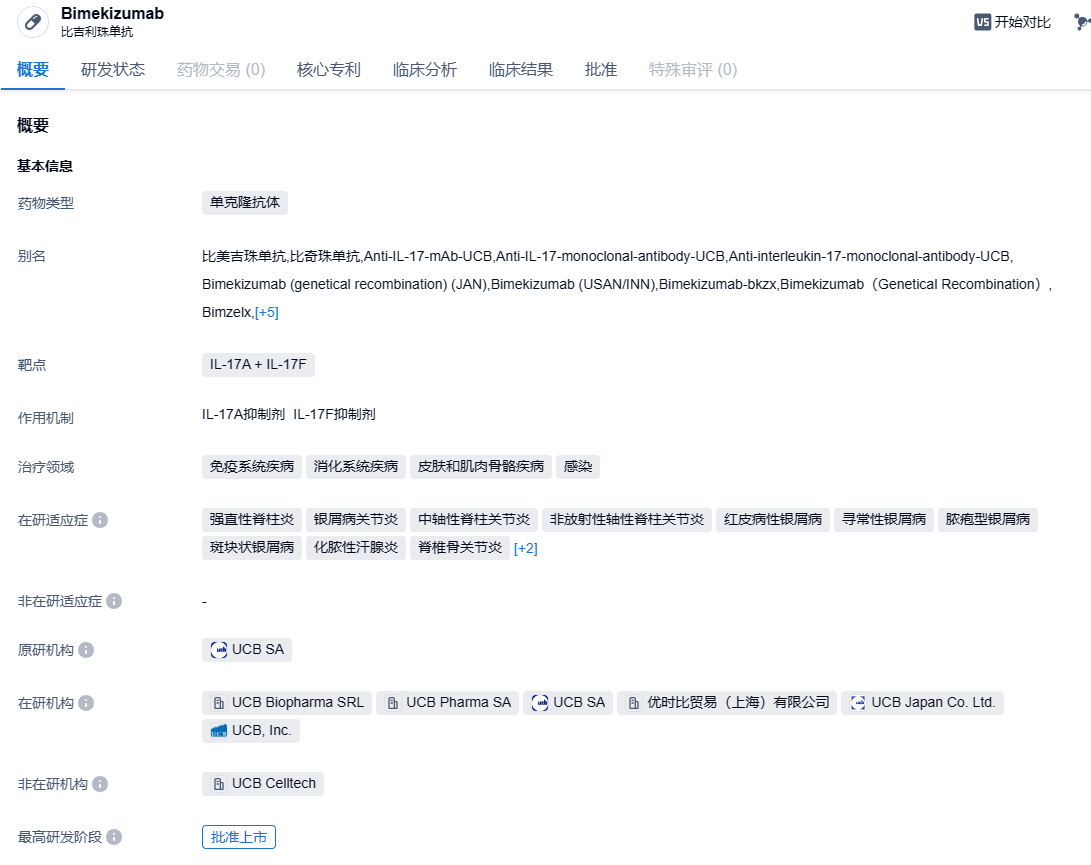
优时比创新疗法IL-17A/F抑制剂bimekizumab获FDA批准,治疗斑块状银屑病
2023年10月19日,优时比(UCB)宣布,美国FDA已批准Bimzelx(bimekizumab)用于治疗适合接受全身治疗或光疗的中重度斑块状银屑病成人患者。bimekizumab是全球首个获批用以治疗中重度斑块状银屑病的白介素-17 A/F(IL-17A/F)抑制剂。
bimekizumab是一种人源化单克隆IgG1抗体,旨在同时抑制白细胞介素 17A(IL-17A)和白细胞介素17F(IL-17F)这两种驱动炎症过程的关键细胞因子。这种独特的作用机制相比于其他IL-17A类药物可能有更好的疗效。bimekizumab于2021年8月在欧盟和英国获批用于适合系统治疗的成人中重度斑块状银屑病,2022年1月在日本获批,用于治疗对现有疗法响应不足的成人斑块状银屑病、泛发性脓疱型银屑病、红皮病型银屑病患者。2022年2月和3月又陆续在加拿大和澳大利亚获批。此次bimekizumab在美国获批,有望给更多患者带来新的治疗选择。
在三项3期研究中评估了bimekizumab与安慰剂和IL-12/IL-23抑制剂ustekinumab(BE VIVID试验)、与安慰剂(BE READY试验)和与TNFα抗体adalimumab(BE SURE试验)相比的疗效和安全性。所有研究均达到其共同主要终点和次要终点。与接受活性对照组(次要终点,BE VIVID;p<0.0001)、安慰剂(共同主要终点,BE READY和BE VIVID;p<0.0001)和adalimumab(共同主要终点,BE SURE;p<0.001)治疗的患者相比,接受bimekizumab治疗的患者在第16周获得了更佳的皮损清除率,即在PASI 90(银屑病面积与严重程度指数改善至少90%)与研究者总体评估(IGA)分数为0(银屑病症状清除)或1(几乎清除)上有显著改善。
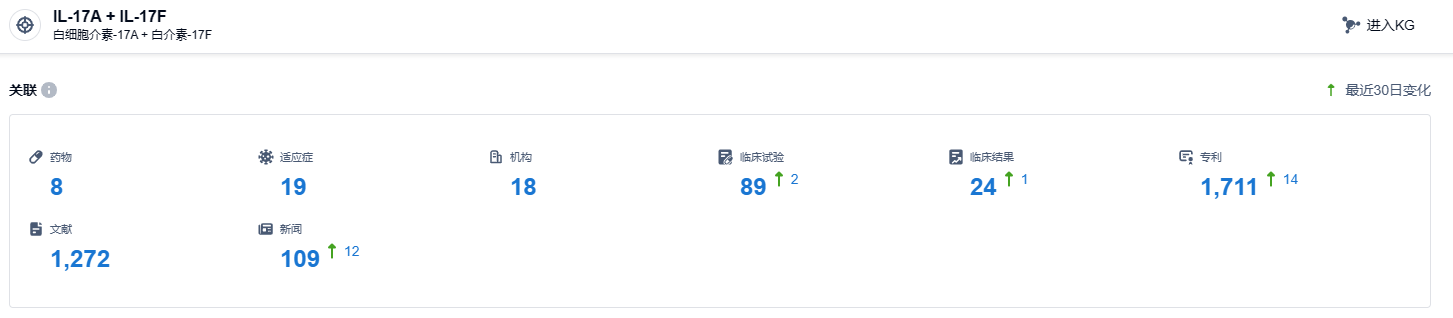
根据智慧芽新药情报库所披露的信息 (点击下方图片直达IL-17A/F靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年10月20日,IL-17A/F靶点共有在研药物8个,包含的适应症有19种,在研机构18家,涉及相关的临床试验89件,专利多达1711件……2023年4月26日,比吉利珠单抗注射液(bimekizumab)在华申报上市,期待该药能够早日在国内获批,为国内患者带来新的治疗选择。