治疗非小细胞肺癌,安进KRAS G12C抑制剂sotorasib有望获得完全批准
日前,安进(Amgen)宣布,美国FDA肿瘤学药物咨询委员会(ODAC)将审评支持将KRAS G12C抑制剂Lumakras(sotorasib)的加速批准转变为完全批准的临床试验数据。委员会会议将在今年10月5日举行。
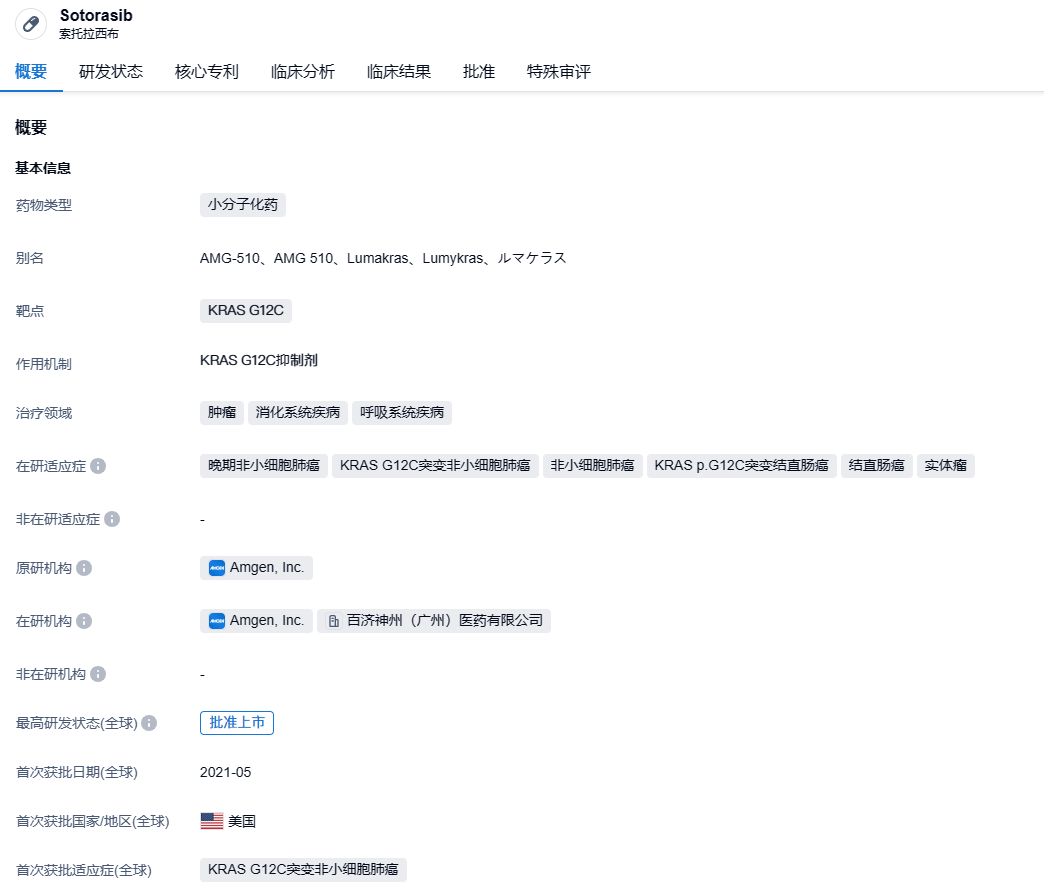
sotorasib是Carmot Therapeutics和安进合作开发的一款KRAC G12C抑制剂研制,百济神州获得其在中国的独家商业化权利。sotorasib(AMG-510)于2021年5月获得美国食品药品监督管理局(FDA)批准上市,适用于治疗既往接受过至少1种全身治疗的KRAS G12C突变型局部晚期或转移性非小细胞肺癌(NSCLC)成人患者(通过FDA批准的检测方法确定)。这是全球首个靶向KRAS突变的抗肿瘤药物。
2022年9月,安进公布了3期临床试验CodeBreaK 200的试验结果。与标准化疗相比,Lumakras将患者疾病进展或死亡风险降低34%(HR:0.66,[95% CI:0.51,0.86];P=0.002)。在接受治疗1年后,Lumakras组的无进展生存率为25%,化疗组这一数值为10%。此外,Lumakras也达到客观缓解率(ORR)的次要终点。Lumakras组的ORR为28%,化疗组为13%(P<0.001)。Lumakras同时改善了疾病控制率(83%比60%)。基于这些数据,安进已经递交了将Lumakras的加速批准转化为完全批准的补充新药申请(sNDA),预计FDA将在今年12月24日之前做出审评结果。
2023年6月27日,clinicaltrials.gov网站上登记了一项安进开展的III期临床试验(CodeBreaK 202),其旨在评估Sotorasib(商品名:Lumakras)联合化疗对比帕博利珠单抗(K药)联合化疗一线治疗IV期或IIIB/C期非鳞状非小细胞肺癌(NSCLC)患者的有效性和安全性。该研究是一项多中心、随机、开放标签的临床试验,拟纳入750例PD-L1阴性且KRAS p.G12C阳性的非鳞状NSCLC患者。研究的主要终点为无进展生存期(PFS)。该研究预计将于2023年9月启动并于2030年11月完成。
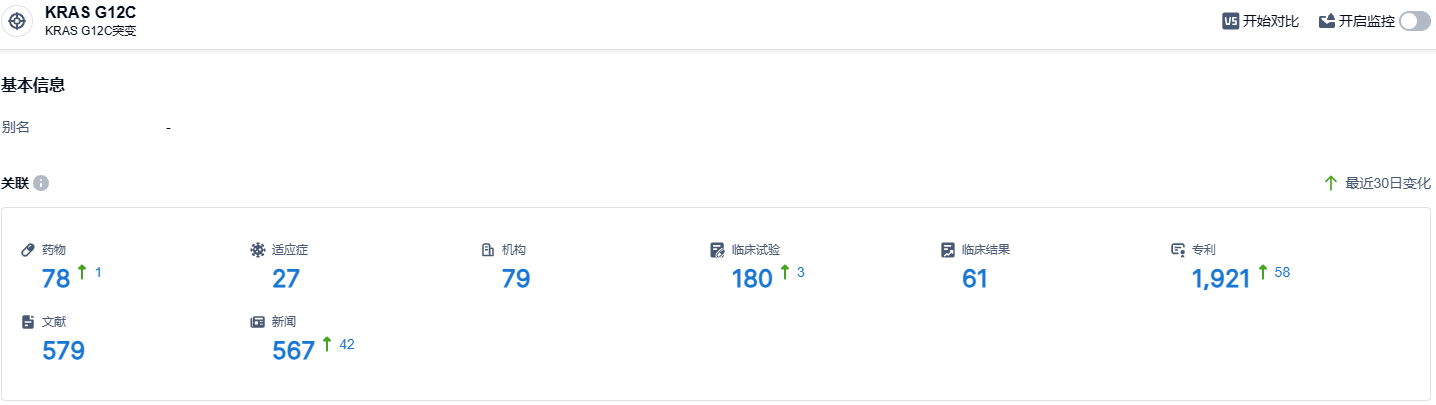
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 KRAS G12C 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月24日,KRAS G12C靶点共有在研药物78个,包含的适应症有27种,在研机构79家,涉及相关的临床试验180件,专利多达1921件……目前FDA已经批准了两款KRAS G12C抑制剂,国内外还有大量处于临床阶段的KRAS G12C抑制剂。KRAS G12C,曾经被认为是“不可成药”,现在已经成为“可成药”最热门的靶标之一。