再鼎医药靶向HER2新药马吉妥昔单抗注射液在国内获批,治疗乳腺癌!
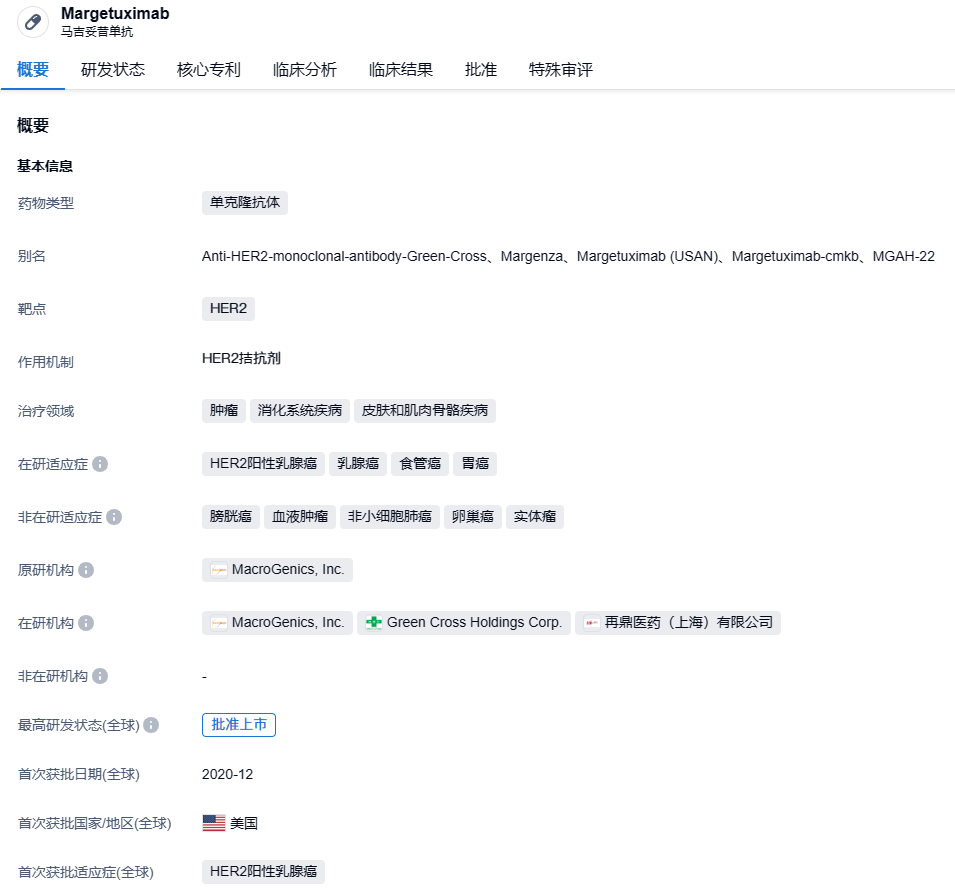
2023年9月1日,中国国家药监局(NMPA)官网最新公示,再鼎医药申报的马吉妥昔单抗注射液已在中国获批上市。公开资料显示,马吉妥昔单抗(margetuximab)是再鼎医药从MacroGenics公司引进的一种作用于HER2的Fc优化型单克隆抗体,本次获批的适应症为用于转移性HER2阳性乳腺癌患者三线及以上治疗。
马吉妥昔单抗(Margetuximab)原研公司MacroGenics,是一种靶向用于人表皮生长因子受体2(HER2)的Fc段优化的单克隆抗体,可增强与刺激性FcγR CD16A的结合和激活,减少与抑制性FcγR CD32B的结合。这使其可以更紧密地结合效应细胞并增强ADCC效应, 同时它也保留了与曲妥珠单抗类似的抗肿瘤增殖特性。2018年11月,再鼎医药与MacroGenics公司达成一项高达1.65亿美元的合作,获得了后者开发的三款免疫肿瘤药物在大中华区(包括中国大陆、香港、澳门和台湾地区)的开发及商业化独家授权,马吉妥昔单抗就是其中之一。体外数据显示,优化的Fc结构域增加了对激活型Fc受体FCGR3A(CD16A)的亲和力,并降低了对抑制型Fc受体FCGR2B(CD32B)的亲和力,这些改变增强了ADCC效应和NK细胞的激活。
此次上市是基于全球性III期SOPHIA研究和注册桥接研究的积极数据。SOPHIA研究结果表明,马吉妥昔单抗是唯一一款在与曲妥珠单抗头对头研究中显示出可延长PFS的抗HER2治疗方案,彰显出了马吉妥昔单抗有望为难治型患者群体提供一项重要的新治疗选择。与曲妥珠单抗联合化疗相比,马吉妥昔单抗联合化疗显著降低了患者的疾病进展或死亡的风险,具有统计学意义(HR=0.76),两组的中位无进展生存期(mPFS)分别为5.8个月和4.9个月。在客观缓解率方面,马吉妥昔单抗联合化疗组为22%,也高于对照组的16%。基于这一研究,美国FDA已于2020年批准了马吉妥昔单抗的上市申请。
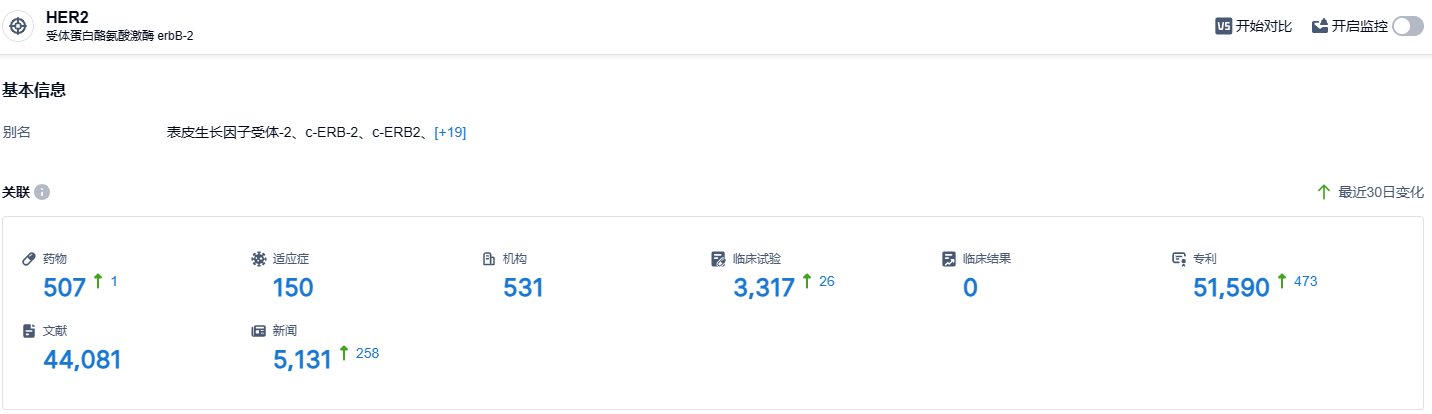
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 HER2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月2日,HER2靶点共有在研药物507个,包含的适应症有150种,在研机构531家,涉及相关的临床试验3317件,专利多达51590件……在乳腺癌患者中,很多患者会过度表达人类表皮生长因子受体2(HER2),HER2蛋白会促进癌细胞的生长,严重影响患者的治疗和预后,超过25%的转移性HER2阳性乳腺癌女性患者会发生脑转移。此次马吉妥昔单抗在国内上市,给广大的乳腺癌患者带来了新的治疗选择。