预约演示
更新于:2025-05-07
Rectal Adenocarcinoma
直肠腺癌
更新于:2025-05-07
基本信息
别名 Adenocarcinoma of Rectum、Adenocarcinoma of rectum、Adenocarcinoma of rectum (disorder) + [23] |
简介 An adenocarcinoma arising from the rectum. It is more frequently seen in populations with a Western type diet and in patients with a history of chronic inflammatory bowel disease. Signs and symptoms include intestinal bleeding, anemia, and change in bowel habits. According to the degree of cellular differentiation, rectal adenocarcinomas are divided into well, moderately, and poorly differentiated. Histologic variants include mucinous adenocarcinoma, signet ring cell carcinoma, medullary carcinoma, serrated adenocarcinoma, cribriform comedo-type adenocarcinoma, and micropapillary adenocarcinoma. |
关联
48
项与 直肠腺癌 相关的药物作用机制 PD-1抑制剂 [+1] |
在研机构 |
原研机构 |
在研适应症 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 中国 |
首次获批日期2024-05-21 |
靶点 |
作用机制 PD-1抑制剂 |
在研机构 |
原研机构 |
最高研发阶段批准上市 |
首次获批国家/地区 欧盟 [+3] |
首次获批日期2021-04-21 |
作用机制 MEK1抑制剂 [+1] |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2020-04-10 |
309
项与 直肠腺癌 相关的临床试验NCT06885034
A Phase1b/2, Multicenter, Randomized, Open-label Study to Evaluate the Efficacy and Safety of GSK5764227 Alone and in Combination in Participants With Previously Treated Advanced Unresectable or Metastatic Gastrointestinal Solid Tumors
This study will check how well a new medicine, GSK5764227, works, how safe it is and how the body handles it in participants all around the world with advanced inoperable or metastatic gastrointestinal cancer who have previously received treatment.
开始日期2025-06-30 |
申办/合作机构 |
NCT06780787
Phase II Clinical Trial of FOLFOX, Botensilimab, Plus Balstilimab in Patients With Localized Rectal Cancer
This phase II trial tests how well fluorouracil, oxaliplatin and leucovorin calcium (folinic acid) (FOLFOX) with botensilimab and balstilimab given before surgery (neoadjuvant) works in treating patients with rectal adenocarcinoma that has not spread to other parts of the body (localized). Currently, neoadjuvant therapy for rectal cancer includes chemotherapy and chemoradiation. Despite these aggressive treatments, only about half of patients achieve a complete clinical response. In fact, over half of rectal cancer patients go on to have surgery and often suffer post-surgery complications involving urine and bowel problems. Thus, there has been an increased focus on non-surgical treatments. Chemotherapy drugs, such as fluorouracil, oxaliplatin and leucovorin calcium, work in different ways to stop the growth of tumor cells, either by killing the cells, by stopping them from dividing, or by stopping them from spreading. Immunotherapy with monoclonal antibodies, such as botensilimab and balstilimab, may help the body's immune system attack the tumor, and may interfere with the ability of tumor cells to grow and spread. Giving neoadjuvant FOLFOX with botensilimab and balstilimab may improve the rate of complete response and decrease the need for surgery and radiation therapy in patients with localized rectal adenocarcinoma.
开始日期2025-06-30 |
申办/合作机构 |
NCT06834126
DINOMITE (Decreasing Hypoxia With Mitochondrial Inhibition in Locally Advanced Rectal Cancer): Phase 1 Trial of Papaverine in Combination With Radiation
This phase I trial studies the side effects and best dose of papaverine (PPV) when given together with radiation therapy (RT) and tests how well it works in treating patients with rectal cancer that has spread to nearby tissue or lymph nodes (locally advanced). PPV is an enzyme inhibitor, and it may stop the growth of tumor cells by blocking some of the enzymes needed for cell growth. RT uses high energy x-rays, particles, or radioactive seeds to kill tumor cells and shrink tumors. Giving PPV with RT may be safe, tolerable, and/or effective in treating patients with locally advanced rectal cancer.
开始日期2025-06-06 |
100 项与 直肠腺癌 相关的临床结果
登录后查看更多信息
100 项与 直肠腺癌 相关的转化医学
登录后查看更多信息
0 项与 直肠腺癌 相关的专利(医药)
登录后查看更多信息
4,299
项与 直肠腺癌 相关的文献(医药)2025-12-31·Annals of Medicine
Overexpression of ST8Sia1 inhibits tumor progression by TGF-β1 signaling in rectal adenocarcinoma and promotes the tumoricidal effects of CD8
+
T cells by granzyme B and perforin
Article
作者: Xiao, Xiao ; Zhang, Chang ; Wang, Yeli ; Yu, Yao ; Pang, Yanchao ; Hao, Leilei
2025-12-01·Endoscopy
Endoscopic submucosal dissection of a rectal lesion using a new flower-shaped multiband traction system
Article
作者: Barranco Priego, Luis ; Urgorri, Agustín Seoane ; Bessa Caserras, Xavier ; Antón Arnal, Marta ; Pantaleón Sanchez, Miguel Angel ; Riu Pons, Fausto ; Batlle Garcia, Marc
2025-12-01·Cancer Chemotherapy and Pharmacology
Dihydropyrimidine enzyme activity and its effect on chemotherapy toxicity: importance of genetic testing
Article
作者: Villano, John L ; Williams, Abby ; Roberts, Danielle ; Shamaei Zadeh, Alexia ; Pandey, Deepali
12
项与 直肠腺癌 相关的新闻(医药)2025-01-21
AUSTIN, Texas--(
BUSINESS WIRE
)--
Natera, Inc.
(NASDAQ: NTRA), a global leader in cell-free DNA and genetic testing, today announced that the first set of abstracts have been released from several studies that will be shared at the American Society of Clinical Oncology’s Gastrointestinal Cancers Symposium (ASCO GI) taking place Jan. 23 – 25, 2025 in San Francisco, CA.
BESPOKE CRC Study
New data will be presented in an oral presentation on Jan. 25 from BESPOKE CRC, a multicenter, prospective, observational study in colorectal cancer (CRC). The study underscores Signatera’s capability as a prognostic and a predictive biomarker in a cohort of over 1,000 patients wherein post-surgical Signatera-positivity was predictive of inferior outcomes in stage II patients [disease-free survival (DFS) (HR=10.4; p<0.0001), and stage III patients (HR=10.1; p<0.0001)]. 24-month DFS estimates for stages II-III combined were 91.7% for Signatera-negative and 41.4% for Signatera-positive. Signatera-positive patients benefitted from adjuvant treatment while Signatera-negative patients did not, and clearance of ctDNA during and after treatment led to superior DFS outcomes.
Additional data from the study will be shared during the symposium illustrating the impact of MRD detection on clinical decision-making. The data show that even in the early days of MRD commercialization, a significant number of oncologists escalated or de-escalated post-surgical chemotherapy plans based on Signatera results, and the vast majority of oncologists found that Signatera results strengthened the treatment plan under consideration. In addition, surveillance with Signatera enabled a high rate of curative-intent surgery among recurrent patients.
Readouts in Tissue-Free MRD and Early Cancer Detection
Initial results from a clinical performance study on Natera’s novel tissue-free MRD detection test will be presented, where high sensitivity and specificity were observed in patients evaluable for clinical outcomes. The study demonstrated that the tissue-free MRD assay was prognostic, with MRD-positive patients showing inferior recurrence-free survival. The data also showed that the test was predictive, as MRD-positive patients benefited from adjuvant therapy whereas MRD-negative patients did not. In addition, the data showed strong concordance between the tissue-free MRD test and the gold standard Signatera test, with a positive percent agreement of 86% (95% CI:77-93%) and a negative percent agreement of 98% (95% CI: 95-100%).
Natera will also present case-control data in early cancer detection, including data from screen-detected colorectal cancer cases from the CIRCULATE study and controls from the PROCEED-CRC study, respectively. The data reports an overall sensitivity of 95% (95% CI: 92-99%) and a specificity of 91% (95% CI: 88-94%). Among patients with stage I disease, sensitivity was 92% overall. Stage-adjusted sensitivity was 91% in screen-detected individuals.
“
This data at ASCO GI demonstrates the ongoing strength of Signatera complemented by our exciting innovation pipeline,” said Adham Jurdi, MD, senior medical director in oncology at Natera. “
The results from BESPOKE CRC highlight the potential value of Signatera-based MRD detection for treatment-decision making, with strong findings in clinical utility. Our readouts in early cancer detection and tissue-free MRD offer great promise for expanding Natera’s portfolio to help millions of additional patients with cancer.”
Full list of Signatera presentations and activities during ASCO GI
Oral Presentations
Jan. 25, 1:00 PM PT | Abstract # 15 | Stage II-III Colorectal Cancer (Oral Presentation)
Presenter: Purvi K. Shah, MD, MBBS, Virginia Cancer Institute
Circulating Tumor DNA for Detection of Molecular Residual Disease (MRD) in Patients (pts) with Stage II/III Colorectal Cancer (CRC): Final Analysis of the BESPOKE CRC sub cohort
Jan. 25, 1:00 PM PT | Abstract # LBA14 | Colon Cancer (Oral Presentation)
Presenter: Jonathan A. Nowak, MD, PhD, Brigham and Women's Hospital
Prognostic and predictive role of circulating tumor DNA (ctDNA) in stage III colon cancer treated with celecoxib: Findings from CALGB (Alliance)/SWOG 80702
P
osters
Jan. 23, 11:30 AM PT | Abstract # TPS512 | Gastroesophageal adenocarcinoma (Poster)
Presenter: Elizabeth Catherine Smyth, MD, Oxford University Hospitals NHS Foundation Trust
A single arm phase II trial of trastuzumab deruxtecan in patients with gastroesophageal adenocarcinoma cancer who are ctDNA and HER2 posiative: DECIPHER
Jan. 23, 11:30 AM PT | Abstract # 836 | Gastrointestinal cancers (Poster)
Presenter: Sakti Chakrabarti, MD, University Hospitals Seidman Cancer Center, Case Comprehensive Cancer Center
Short interval circulating tumor DNA (ctDNA) kinetics as a predictor of tumor response in patients with gastrointestinal (GI) cancer receiving immune checkpoint inhibitor (ICI)-based treatment
Jan. 25, 7:00 AM PT | Abstract # 266 | Tissue-free MRD testing (Poster)
Presenter: John Paul Y.C. Shen, MD, University of Texas MD Anderson Cancer Center
Development of a methylation-based, tissue-agnostic test for the detection of molecular residual disease by circulating tumor DNA
Jan. 25, 7:00 AM PT | Abstract # 232 | Early cancer detection: colorectal cancer (Poster)
Presenter: Yoshiaki Nakamura, MD, PhD, Department of Gastroenterology and Gastrointestinal Oncology, National Cancer Center Hospital East
Performance of a blood-based screening test for the early detection of colorectal cancer
Jan. 25, 7:00 AM PT | Abstract # TPS306 | Early cancer detection: Trial in Progress (Poster)
Presenter: Sarah Sawyer, PhD, Clinical Trial Operations, Natera, Inc. Austin, TX, USA
Trial in progress for a colorectal cancer detection blood test
Jan. 25, 7:00 AM PT | Abstract # LBA 22 | Colorectal cancer (Poster)
Presenter: Hideaki Bando, MD, National Cancer Center Hospital Japan
A Randomized, Double-Blind, Phase III Study Comparing Trifluridine/Tipiracil (FTD/TPI) Versus Placebo in Patients with Molecular Residual Disease Following
Curative Resection of Colorectal Cancer (CRC): The ALTAIR Study
Jan. 25, 7:00 AM PT | Abstract # 220 | Metastatic colorectal cancer (Poster)
Presenter: D.E. van Steijn, MSc, Netherlands Cancer Institute
Longitudinal ctDNA measurements for treatment response monitoring in patients with
metastatic colorectal cancer undergoing systemic therapy: The ORCA trial
Jan. 25, 7:00 AM PT | Abstract # 284 | Locally advanced rectal cancer (Poster)
Presenter: Jun Watanabe, MD, PhD, Department of Colorectal Surgery, Kansai Medical University
Circulating tumor DNA for predicting complete response to total neoadjuvant therapy
in locally advanced rectal cancer: ENSEMBLE-2
Jan 25, 7:00 AM PT | Abstract # 263 | Rectal adenocarcinoma (Poster)
Presenter: Seth Felder, MD, H. Lee Moffitt Cancer Center
Correlation of mid-chemoradiation ctDNA results and clinical complete response to total neoadjuvant therapy (TNT) for locally advanced rectal adenocarcinoma
Jan 25, 7:00 AM PT | Abstract # 48 | Colorectal cancer (Poster)
Presenter: Elisabeth Arrondo, BSc, Translational Research Support Office, National Cancer Center Hospital East
Molecular characteristics and prognostic impact of GNAS mutation in colorectal cancer: An international collaborative study between United States and Japan
About Signatera
Signatera
is a personalized, tumor-informed, molecular residual disease test for patients previously diagnosed with cancer. Custom-built for each individual, Signatera uses circulating tumor DNA to detect and quantify cancer left in the body, identify recurrence earlier than standard-of-care tools, and help optimize treatment decisions. The test is available for clinical and research use and is covered by Medicare for patients with colorectal cancer, breast cancer, ovarian cancer, and muscle-invasive bladder cancer, as well as for immunotherapy monitoring of any solid tumor. Signatera has been clinically validated across multiple cancer types and indications, with published evidence in over 100 peer-reviewed papers.
About Natera
Natera™ is a global leader in cell-free DNA and genetic testing, dedicated to oncology, women’s health, and organ health. We aim to make personalized genetic testing and diagnostics part of the standard of care to protect health and inform earlier, more targeted interventions that help lead to longer, healthier lives. Natera’s tests are validated by more than 250 peer-reviewed publications that demonstrate high accuracy. Natera operates ISO 13485-certified and CAP-accredited laboratories certified under the Clinical Laboratory Improvement Amendments (CLIA) in Austin, Texas, and San Carlos, California. For more information, visit
www.natera.com
.
Forward-Looking Statements
All statements other than statements of historical facts contained in this press release are forward-looking statements and are not a representation that Natera’s plans, estimates, or expectations will be achieved. These forward-looking statements represent Natera’s expectations as of the date of this press release, and Natera disclaims any obligation to update the forward-looking statements. These forward-looking statements are subject to known and unknown risks and uncertainties that may cause actual results to differ materially, including with respect to whether the results of clinical or other studies will support the use of our product offerings, the impact of results of such studies, our expectations of the reliability, accuracy, and performance of our tests, or of the benefits of our tests and product offerings to patients, providers, and payers. Additional risks and uncertainties are discussed in greater detail in "Risk Factors" in Natera’s recent filings on Forms 10-K and 10-Q, and in other filings Natera makes with the SEC from time to time. These documents are available at
www.natera.com/investors
and
www.sec.gov
.
临床结果ASCO会议临床2期免疫疗法临床3期
2025-01-14
▎药明康德内容团队编辑
局部晚期直肠癌(LARC)的标准治疗以新辅助治疗并行根治性手术为主。近年来,新辅助免疫治疗也被证实具有诱导肿瘤消退的作用,特别在“热肿瘤”中,如错配修复缺陷(dMMR)型LARC采用新辅助PD-1抑制剂单药治疗,临床完全缓解率可达到惊人的100%。但在诸如错配修复完整(pMMR)结直肠癌,这类“冷肿瘤”中,单独的免疫治疗并不能引起具有临床意义的肿瘤消退。但残酷的现实是,超过93%的LARC属于错配修复完整型。临床医生也在探索如何利用现有治疗方案,将“冷肿瘤”转化为“热肿瘤”,为免疫治疗提供最佳肿瘤微环境,从而提高患者的治疗效果。
近日,Nature Medicine发表的POLARSTAR试验结果表明,新辅助放化疗后增加PD-1抑制剂,可增加LARC患者的病理完全缓解(pCR)率(即原发病灶和淋巴结内均无残留癌细胞),且不会引起实质性的安全性问题。该研究通讯作者为北京友谊医院张忠涛教授、姚宏伟教授,北京协和医院肖毅教授,以及北京大学肿瘤医院武爱文教授。
截图来源:Nature Medicine
POLARSTAR试验是一项多中心、三臂、随机2期临床试验,纳入了中国8家结直肠癌中心年龄18~75岁直肠腺癌患者186例。研究人员将患者以1:1的比例随机分组接受治疗,而后进行根治性手术。
新辅助放化疗+同步PD-1抑制剂组(下简称“同步治疗组”,63例):放疗开始后1周,给予首剂替雷利珠单抗(200 mg静脉滴注,3个周期,间隔3周);放疗治疗结束后8~12周行根治性手术治疗;
新辅助放化疗+序贯PD-1抑制剂组(下简称“序贯治疗组”,62例):放疗结束后2周,给予首剂替雷利珠单抗;放疗治疗结束后6~12周行根治性手术治疗;
单独新辅助放化疗组(61例):仅接受放化疗作为新辅助治疗策略。
三组的新辅助放化疗方案均为:45~50.4 Gy(分25~28次)+卡培他滨口服给药(825 mg/m2,每日2次,每周5天,持续5周)。
▲三组治疗方案(图片来源:参考文献[1])
最终共有171例患者被纳入分析,以上三组分别有59例、56例和56例患者。
研究结果显示,纳入分析(下图中间mITT)的患者中,同步治疗组、序贯治疗组和单独新辅助放化疗组的pCR率分别为27.1%(16/59)、32.7%(18/56)和14%(8/56)。相比之下,序贯治疗组的pCR率显著高于单独新辅助放化疗组,患者比例翻倍(RR=2.332,95%CI:3.4%~34.0%,P=0.019),而同步治疗组的pCR率与单独新辅助放化疗组之间并无显著差异(P=0.082)。此外,研究人员对不同统计口径的人群(意向治疗人群、修订后意向治疗人群和符合方案人群)进行分析,均发现了相似结果。
▲意向治疗人群(即最初符合纳入条件的186例患者,ITT)、修订后意向治疗人群(即被纳入主要分析的171例患者,mITT)和符合方案人群(即完全按照治疗方案进行治疗的患者,PP)的同步治疗组(粉色)、序贯治疗组(蓝色)和单独新辅助放化疗组(灰色)pCR率对比(图片来源:参考文献[1])
文章表示,同步治疗组和序贯治疗组分别设计在放疗第8天和放疗结束后2周,给予首剂PD-1抑制剂,目的是在开始免疫治疗前利用放化疗的微环境调节作用。序贯治疗组的pCR率高于同步治疗组,可能原因是完成整个放化疗后,微环境变化更彻底。
次要终点方面,无论通过是通过哪种统计口径(意向治疗人群、修订后意向治疗人群和符合方案人群)对患者数据进行分析,相比于单独新辅助放化疗组,同步治疗组和序贯治疗组在影像学结果、病理学结果方面的数据均显示出获益优势。从获益程度看,尽管主要终点上,同步治疗组并未显示出显著优势,但也存在诱导病理学肿瘤消退的可能性。
安全性方面,同步治疗组、序贯治疗组和单独新辅助放化疗组手术并发症发生率分别为15%(9/59)、20%(11/55)和12%(7/57),整体安全可控,并未引起实质性安全问题。
总之,本次研究结果显示,相比于单独新辅助放化疗组,序贯治疗组的pCR率显著且具有临床意义的增加。可初步认为,“新辅助放化疗+PD-1抑制剂”的组合,可有效促进肿瘤消退,且仍存在持续优化的潜力。这种组合模式或可作为传统治疗方式的补充,是一种有效且不良反应较少的方式。
点击文末“阅读原文/Read more”,即可访问Nature Medicine官网阅读完整论文。
推荐阅读
欢迎投稿:学术成果、前沿进展、临床干货等主题均可,点此了解投稿详情。
参考资料
[1] Yang Y, Pang K, Lin G, et al. Neoadjuvant chemoradiation with or without PD-1 blockade in locally advanced rectal cancer: a randomized phase 2 trial. Nat Med (2025). https://doi.org/10.1038/s41591-024-03360-5
免责声明:药明康德内容团队专注介绍全球生物医药健康研究进展。本文仅作信息交流之目的,文中观点不代表药明康德立场,亦不代表药明康德支持或反对文中观点。本文也不是治疗方案推荐。如需获得治疗方案指导,请前往正规医院就诊。
版权说明:本文来自药明康德内容团队,欢迎个人转发至朋友圈,谢绝媒体或机构未经授权以任何形式转载至其他平台。转载授权请在「医学新视点」微信公众号留言联系。
如有其他合作需求,请联系wuxi_media@wuxiapptec.com
分享,点赞,在看,传递医学新知
临床结果临床3期免疫疗法临床2期
2025-01-13
·药学进展
“
点击蓝字 关注我们
山长亮
南开大学药学院教授、博士生导师,南开大学百名青年学科带头人,南开大学第九届“良师益友”十佳奖获得者。主持国家自然科学基金面上项目、京津冀基础研究合作专项项目和天津市自然基金重点项目。任中国抗癌协会抗癌药物专业委员会委员、中国细胞生物学学会肿瘤细胞生物学学会委员和中国抗癌协会肿瘤细胞代谢专业委员会委员等。Signal Transduct Target Ther, Mol Cell, Acta Pharm Sin B, Cell Rep, iScience, EbioMedicine, Cancer Lett, Acta Pharmacol Sin (2022 年度优秀审稿人 ), Acta Biochim Biophys Sin(2022 年度优秀审稿人 ) 和 Biochem Pharmacol 等杂志审稿人。长期从事肿瘤代谢酶表观修饰调控与化学干预研究,在 Nat Cell Biol, Nat Chem, Mol Cell, Cell Res, Acta Pharm Sin B, Acta Pharmacol Sin, J Exp Clin Cancer Res 和 Pharmacol Res 等期刊发表学术论文 50 余篇,总引用 4 000 余次(Google Scholar),h-index 为 26。
靶向氧化磷酸戊糖途径代谢酶小分子抑制剂的研究进展 PPS
孙焕然 #,张琦军 #,山长亮 *
(南开大学药学院,天津 300350)
[ 摘要 ] 磷酸戊糖途径(pentose phosphate pathway, PPP)是葡萄糖分解代谢的重要途径,其作为连接糖代谢和核苷酸代谢的桥梁,为细胞增殖提供所需的核糖。报道显示,PPP 关键酶在肿瘤细胞中普遍高表达,靶向该途径已成为抗肿瘤药物研发的有效策略。综述靶向氧化 PPP 关键酶小分子抑制剂的研究进展,以期为相关领域药物研发提供新的思路。
葡萄糖是细胞生命活动所必需的物质。细胞通过氧化分解葡萄糖获取细胞各项生命活动所需的能量和物质。同时,细胞中还存在葡萄糖的多种代谢途径,提供细胞代谢活动所需物质。例如,细胞可通过磷酸戊糖途径(pentose phosphate pathway,PPP),将葡萄糖转化为 5-磷 酸 核 糖(ribose-5-phosphate,R5P)并产生还原型辅酶Ⅱ,即还原型烟酰胺腺嘌呤二核苷酸磷酸(reduced nicotinamide adenine dinucleotide phosphate,NADPH)。肿瘤细胞相较于正常细胞存在许多生理活动的异常,多种内在和外在的分子机制共同作用,改变核心细胞代谢,并为细胞增殖的 3 个基本需求提供支持,包括快速生成 ATP 以维持能量状态,增加大分子的生物合成以及加强维持适当的细胞氧化还原状态 [1]。在肿瘤细胞中,由于代谢的加速,肿瘤细胞 DNA 合成保持活跃,并且活性氧类(reactive oxygen species,ROS)水平也高于正常细胞。在肿瘤细胞中观察到的最典型的代谢特征是 Warburg 效应,即肿瘤细胞不通过氧化磷酸化而是通过糖酵解产生 ATP,即使在正常的氧浓度下也是如此 [2]。因此,与大多数正常细胞不同,许多肿瘤细胞从有氧糖酵解中获得大量能量,将大部分吸收的葡萄糖转化为乳酸,而不是通过氧化磷酸化在线粒体中代谢 [3]。尽管糖酵解产生ATP 的速度比氧化磷酸化更快,但就单位葡萄糖消耗产生的ATP而言,其效率远低于氧化磷酸化。因此,这种转变要求肿瘤细胞实现异常高的葡萄糖摄取率,以满足其增加的能量、生物合成和氧化还原需求。
PPP 分为氧化阶段和非氧化阶段。在氧化阶段,细胞首先通过葡萄糖-6-磷酸脱氢酶(glucose 6-phosphate dehydrogenase,G6PD), 将 6-磷酸葡萄糖(glucose-6-phosphate,G6P)不可逆地转变为6-磷 酸 葡 萄 糖 酸 内 酯(6-phosphogluconolactone,6PG)并生成 NADPH,之后由 6-磷酸葡萄糖酸内酯酶(6-phosphogluconolactonase,6PGL) 将 6PG水解为6-磷酸葡萄糖酸(6-phosphogluconate),再经过 6-磷酸葡萄糖酸脱氢酶(6-phospho-gluconate dehydrogenase,6PGD)催化脱氢脱羧,生成5-磷酸核酮糖(ribulose-5-phosphate,Ru5P),并产生第 2 个 NADPH(见图 1)。随 后,Ru5P 通过重排产生 R5P 用于细胞合成核酸,或转化为糖酵解途径中的 2 个中间代谢物 6-磷酸果糖(fructose-6-phosphate,F6P)和 3-磷酸甘油醛(glyceraldehyde-3-phosphate,G3P)。通过PPP,在不可逆的氧化阶段,G6P 被转化为 R5P,用于核酸以及辅酶合成,并生成 NADPH,维持胞内氧化还原平衡。对于肿瘤细胞,PPP 非常重要。肿瘤细胞不仅 DNA 合成活跃,需要大量还原力,而且较高的 ROS 水平也需要更多NADPH 来维持氧化还原平衡。因此许多研究人员希望通过靶向抑制 PPP,抑制肿瘤增殖从而治疗癌症。本文针对氧化 PPP,从相关癌症和小分子抑制剂研究进展等方面进行综述,为相关领域药物的进一步研发提供参考。
1
氧化 PPP 途径关键酶
1.1 G6PD
G6PD 是一种管家酶,存在于所有组织和器官中,在哺乳动物组织中普遍表达,并且在多种癌症中高表达 [4]。G6PD 通过将 PPP 中的烟酰胺腺嘌呤二核苷酸磷酸(nicotinamide adenine dinucleotide phosphate,NADP+)还原为 NADPH(见图 2),在维持细胞中正常的氧化还原电位方面发挥着关键作用 [5]。肿瘤细胞 PPP 通量更高,其限速酶 G6PD 表达也更多。由于细胞通过 G6PD 将 G6P 转变为 6PG是不可逆的过程,对于 PPP 来说 G6PD 的表达量和酶的活性决定整个通路的流量 [6]。与正常组织相比,胆管癌、结肠腺癌、急性髓系白血病、肝癌、直肠腺癌、胰腺癌、皮肤黑色素瘤、胃腺癌和睾丸肿瘤样本中 G6PD 表达有显著变化 [7-10]。众多研究表明,G6PD 的活性在多种类型癌症中升高,且其与肿瘤患者的总生存期、不良预后、肿瘤进展及其化疗耐药有关。在具有瑞戈非尼耐药性的肝癌细胞敲除 G6PD 或使用 G6PD 抑制剂可以增强瑞戈非尼的抗癌作用;反之,过表达 G6PD 会削弱瑞戈非尼对肝癌细胞的影响。研究表明,在胰腺导管癌中抑制 G6PD 可以下调 NADPH 和谷胱甘肽(glutathione,GSH)水平促进铜死亡从而增强对高糖代谢水平胰腺导管癌的化疗效果 [8]。与正常组织相比,肺腺癌和肺鳞癌的肿瘤组织中 G6PD 显著上调且与肺癌患者总生存期(overall survival,OS)负相关。通过敲除 G6PD 可以增强非小细胞肺癌细胞中 T790M突变型表皮生长因子受体(epidermal growth factor receptor,EGFR)的降解,克服 EGFR T790M 突变引起的非小细胞肺癌患者对第 1 代酪氨酸激酶抑制剂的耐药性 [11]。通过敲低多发性骨髓瘤(multiple myeloma,MM)细胞中的 G6PD 抑制其活性,可以促进细胞氧化应激进而增强 MM 细胞对地塞米松的敏感性 [12]。因此,针对 G6PD 靶点开发小分子抑制剂是一种可行的肿瘤治疗策略。
1.2 6PGL
在 PPP 的氧化阶段,6PGL 将 6PG 水解为 6-磷酸葡萄糖酸。最初 6PG 向 6-磷酸葡萄糖酸的转化被认为是一种非酶反应,原因是 6PG 非常不稳定,在中性条件下会发生水解。然而,6PG 向 6-磷酸葡萄糖酸的转化以相对较慢的速度发生,表明该过程为酶促反应,最终发现了 6PGL 的存在(见图 3)。据报道红细胞中 6PGL 的突变会导致特定人群的溶血性贫血 [13]。癌症基因组图谱数据库显示,6PGL高表达与肝癌患者预后不良相关,通过抑制 6PGL活性可以抑制肝癌细胞的增殖和转移,促进肝癌细胞凋亡 [14]。
1.3 6PGD
6PGD 是 PPP 的关键酶,在其氧化阶段,6PGD将 6- 磷酸葡萄糖酸转化为 Ru5P 并产生 NADPH(见图 4)。6PGD 在结肠癌、乳腺癌、甲状腺癌、前列腺癌、肺癌、肝癌等癌症细胞中高表达 [15-17]。在 Chen 等 [18] 的报道中,抑制肝癌细胞中高表达的 6PGD 可以激活 AMP 活化蛋白激酶和乙酰辅酶 A 羧化酶 1,并降低肝癌中 NADPH/ 烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)和还原型烟酰胺腺嘌呤二核苷酸(reduced nicotinamide adenine dinucleotide,NADH)的水平,导致 NAD+ 依赖性组蛋白脱乙酰酶 sirtuin1(SIRT1)活性降低和诱发氧化应激,提高肝癌细胞对化疗药物的敏感性。
6PGD 存在许多翻译后修饰影响其活性。2014年,Shan 等 [19] 发现二氢硫辛酸转乙酰基酶和乙酰辅酶 A 乙酰转移酶 2 分别作为 6PGD K76 和 K294位点的上游乙酰转移酶,使 6PGD 发生乙酰化而被激活;并且在癌细胞中表达乙酰基缺陷的 6PGD 突变体会显著减弱细胞增殖和肿瘤生长。Sun 等 [20]发现,蛋白精氨酸甲基转移酶 6(protein arginine methyltransferase 6,PRMT6)可以甲基化 6PGD 的R324 位点提高 6PGD 活性从而促进磷酸戊糖代谢的发生。通过敲低 PRMT6 可以有效减少氧化 PPP 通量,抑制糖酵解途径和肿瘤生长,并增强顺铂对肺癌的抗肿瘤作用。Liu 等 [21] 则报道,EGFR 激活时,6PGD 的 481 位点处的酪氨酸被 Src 家族激酶 Fyn磷酸化。这种磷酸化会增加 6PGD 与 NADP+ 的结合亲和力进而增强 6PGD 活性,从而激活 PPP 产生NADPH 和 Ru5P,维持肿瘤细胞中 ROS 水平并加速 DNA 合成;而抑制 6PGD Y481 磷酸化(pY481)可显著减弱表皮生长因子(epidermal gowth facor,EGF)促进的胶质瘤细胞增殖、肿瘤生长和放疗的耐受性。因此,靶向 6PGD 设计相关小分子抑制剂,对于提高肿瘤对化疗及放疗的敏感性,提高治疗效果具有广阔的应用前景。
2
靶向氧化 PPP 的小分子抑制剂
G6PD 和 6PGD 均是 PPP 的关键酶,在人类多种恶性肿瘤中表达上调,与患者不良预后和耐药性密切相关。因此 G6PD 和 6PGD 被认为是癌症治疗的潜在靶点。目前,已有多种天然或人工合成的 G6PD 小分子抑制剂 [11, 22-36] 和 6PGD 小分子抑制剂 [15, 37-39] 陆续被报道(见表 1)。本节主要针对这 2 种酶的小分子抑制剂进行综述。
2.1 G6PD 的小分子抑制剂
2.1.1 6-AN 6-AN(1)为 G6PD 竞争性抑制剂,6-AN与内源性NADP+竞争其结合位点而使G6PD失活[40]。既往研究表明,6-AN 抑制 G6PD 可以恢复癌细胞对化疗的敏感性,因此被广泛应用于癌症的治疗 [23]。Feng 等 [22] 发现 6-AN 可以逆转紫杉醇耐药。Poulain等 [24] 发现 6-AN 靶向 G6PD,可以在体内和体外抑制白血病细胞活性,增强白血病细胞对化疗的敏感性。另外,6-AN 也能显著抑制膀胱癌细胞的增殖,与顺铂协同发挥抗肿瘤作用 [25]。
2.1.2 DHEA 及 G6PD i-1 早在 1960 年,最著名的类固醇衍生物——DHEA(2),一种由肾上腺分泌产生的甾类激素,就已被发现可以作为 G6PD 的抑制剂。DHEA 可以非竞争性结合 G6PD,从而抑制 G6PD 发挥作用。在各种癌症类型中,DHEA 在体外和体内均具有良好的抗肿瘤活性 [41-43]。此后,DHEA 及其衍生物在数百项研究中被用作 G6PD 抑制剂。尽管 DHEA 对体外 G6PD 的活性有较明显的抑制作用,有研究人员提出 DHEA 可能不是通过与G6PD 结合,抑制其活性而发挥抗肿瘤作用[44]。为了探究这一问题,2020 年 Ghergurovich 等 [26] 开发了代谢组学和氘示踪方法来监测细胞 G6PD 活性。通过实验,作者证实了 DHEA 不能有效抑制细胞中G6PD 活性,其 IC50 为 9 μmol· L-1。有文献报道,非甾体氨基喹唑啉酮类化合物可以抑制克鲁兹锥虫G6PD[45]。通过对其进行结构优化,作者得到了一个更有效的 G6PD 小分子抑制剂 G6PD i-1(3),其 IC50 为 0.07 μmol· L-1,远低于 DHEA。随后,作者评估了 G6PD i-1 抑制不同细胞 G6PD 活性的能力,发现 G6PDi-1 更容易抑制活化的免疫细胞中的G6PD 活性。其可以显著降低淋巴细胞内 NADPH,减少 T 细胞中炎性细胞因子的产生,并抑制中性粒细胞中氧化呼吸爆发。
2.1.3 wedelolactone 2021 年,Luo 等 [27] 报道了新发现的 G6PD 抑制剂 wedelolactone(4)。作者首先通过检测 NADPH 在 340 nm 处吸光值(OD340)的变化,建立了基于酶动力学的高通量筛选方法。应用此方法,作者从约 3 000 个化合物中成功鉴定出能非竞争性抑制 G6PD 的化合物 wedelolactone。表面等离子共振实验结果显示 wedelolactone 与 G6PD蛋白存在相互作用,Kd 为 3.64 μmol· L-1。细胞水平上,wedelolactone 可以通过靶向 G6PD 抑制卵巢癌细胞增殖。
2.2 6PGD 的小分子抑制剂
2.2.1 physcion 及其衍生物 S3 Lin 等 [37] 在 2015 年报道了首个 6PGD 抑制剂 physcion(5)。研究人员通过 6PGD 体外酶活实验,从 2000 个美国食品药品监督管理局(Food and Drug Administration,FDA)批准的小分子化合物中筛选出候选药物 physcion,并通过结构优化得到了 physcion 衍生物 S3(6)。相比于 physcion,该衍生物溶解性更好,Kd 更小,IC50更低。Physcion 及其衍生物 S3 特异性抑制 6PGD,而对其他 NADP+ 依赖的代谢酶如 G6PD,谷氨酸脱氢酶(glutamate dehydrogenase,GLUD)和磷酸甘油酸变位酶 1(phosphoglycerate mutase 1,PGAM1)等没有作用。随后,作者通过分子对接实验进一步验证 physcion 与 6PGD 的结合模式,发现 physcion位于 6PGD 底物 6PG 结合位点附近的口袋中,周围是 6PGD 的 Met 15,Lys 76,Lys 261 和 His 452 残基。Physcion 与这些残基形成疏水相互作用,并通过其 10-酮基团与 Asn 103 形成氢键。体外 6PGD 酶活实验结果显示 physcion 及其衍生物 S3 对 6PGD M15A 突变体没有抑制效果。以上结果证明 6PGD是 physcion 及其衍生物 S3 作用的主要靶点。细胞增殖和动物实验证实了 physcion 及其衍生物 S3 可以有效抑制 6PGD,进而抑制肿瘤细胞增殖和小鼠异种移植瘤的肿瘤生长。
2.2.2 有机硒化合物ebselen Feng 等 [38] 通过分析之前研究中 6PGD 抑制剂的筛选数据,从 2000 个FDA 批准的药物中又鉴定出另一个 6PGD 酶活性抑制剂 ebselen(7)。为了验证这一发现,作者使用重组 6PGD 蛋白,进行体外 6PGD 酶活实验。结果显示,ebselen 以剂量依赖性方式抑制 6PGD 酶活性。基于 6PGD 晶体结构的分子对接研究表明 ebselen 位于 NADP+ 结合位点附近的一个口袋,被 6PGD 的Lys76,Ays103,Lys184 和 Lys261 残基包围。通过6PGD 蛋白与 ebselen 的热转移实验观察到,随着ebselen 孵育浓度的增加,6PGD 的熔化温度呈剂量依赖性增加,证明了 6PGD 能够与 ebselen 直接结合。Ebselen 对 6PGD 酶活性的抑制作用可以被 NADP+逆转,进一步说明 ebselen 是 6PGD 的竞争性抑制剂。Ebselen 是一种有机硒化合物,具有抗炎、抗氧化和潜在的抗癌活性。作者通过细胞和动物实验证明了ebselen可以靶向6PGD抑制癌细胞增殖和肿瘤生长。
2.2.3 木脂素类化合物syringaresinol 和 cleomiscosin A Khan 等 [39] 在 2022 年报道了 2 种 6PGD 的抑制剂。作者通过基于结构的虚拟筛选、分子动力模拟和体外酶活实验,从17 000个天然化合物中筛选出 2 个易获取的 6PGD 潜在抑制剂 syringaresinol(8)和cleomiscosin A(9)。Syringaresinol 和 cleomiscosin A均属于木脂素类化合物。据报道该类化合具有抗癌药理活性,在开发为抗癌药物方面具有十分广阔的前景;MTT 实验证明了 syringaresinol 和 cleomiscosin A 能够抑制肺癌 A549 细胞增殖,流式细胞术实验也证实化合物以剂量依赖的方式诱导 A549 细胞凋亡,然而还需要进行体内实验进一步验证其有效性 [39]。
3
总结与展望
能量代谢重编程通过调节能量代谢促进细胞快速生长和增殖,被认为是肿瘤细胞的独特标志 [46]。肿瘤细胞通过增强 PPP 通 量, 合 成 NADPH 和Ru5P,来维持氧化还原平衡并满足其核糖核苷酸合成需求。许多研究表明 PPP 的多个代谢酶,如氧化阶段的关键酶 G6PD,6PGD 和非氧化阶段的关键酶转酮醇酶在人类多种癌症类型中高表达,促进肿瘤的发生和发展 [32, 47-50]。针对这些酶筛选或设计的一些小分子抑制剂可以通过抑制酶活性或者表达来抑制肿瘤的生长和侵袭,逆转耐药。
迄今为止,研究人员发现了许多可以靶向G6PD 的抑制剂包括 6-AN,DHEA,G6PDi-1 以及wedelolactone 等。这些抑制剂在临床前研究中显示出靶向 G6PD 优异的肿瘤抑制效果。其中最经典、应用最广泛的是 DHEA。然而,有报道显示其可能存在脱靶效应。DHEA 在体外能显著抑制 G6PD酶活性,但是不能有效抑制细胞内 G6PD 活性。DHEA 对细胞的抑制作用很可能是由于其脱靶效应而非直接与 G6PD 结合,抑制其活性所导致 [26]。另外,DHEA 在体内代谢快,会转化为有活性的雄激素。因此,其作为G6PD抑制剂的有效性仍存在争议。另一种 G6PD 抑制剂 6-AN 存在导致神经损伤和维生素 B 缺乏等毒性和副作用,限制了其临床应用。一些新型的 G6PD 抑制剂正在研发中,可能会在未来应用于临床。
近年来,越来越多的具有高选择性和高活性的6PGD 小分子抑制剂被发现。2015 年 Lin 等 [37] 报道了首个 6PGD 抑制剂 physcion 及其衍生物 S3,其可有效抑制酶活性,抑制肿瘤细胞生长,而并不影响人正常细胞如人真皮成纤维细胞和正常人皮肤黑色素细胞的增殖。在体内,S3 能显著抑制小鼠异种移植瘤的肿瘤生长,而不会产生明显的毒性和副作用。Physcion 及其衍生物 S3 因其对肿瘤细胞的高选择性和低毒性,已被广泛应用于 6PGD 和癌症等相关研究。与 physcion 及其衍生物 S3 一样,ebselen 也具有选择性强而毒性低的特点。其能抑制肺癌、乳腺癌及白血病细胞 6PGD 活性,导致其细胞活力降低,然而对人正常的细胞活力没有显著影响。同样,ebselen 在体内对肿瘤生长也具有特异性抑制作用。目前,许多 6PGD 小分子抑制剂如syringaresinol 和 cleomiscosin A 的研究并不深入,它们在体内的有效性以及是否可以进一步用于临床仍是未知的。
研究表明 PPP 关键酶抑制剂与多种化疗药物联合使用具有良好的抗肿瘤活性。靶向 PPP 关键酶已成为抗肿瘤药物研发的有效途径,PPP 关键酶的抑制剂的开发前景十分广阔。尽管已有许多活性与选择性较好的小分子抑制剂被报道,但绝大部分还处于实验室研究阶段,只有少数抑制剂如 DHEA 进入临床试验,且尚无抑制剂获批上市。PPP 关键酶抑制剂的开发仍面临着一些挑战。未来研究方向可以聚焦于 2 个方面:其一,筛选更多的天然小分子抑制剂提高成药性;其二,对已有的小分子抑制剂进行结构改造,提高其活性、选择性和特异性,降低毒性和副作用,进而将科研成果转化为临床应用,改善常规化疗的治疗效果,提高肿瘤对化疗药物的敏感性,为癌症患者提供新的治疗策略。
参考文献 :
[1] An F, Chang W, Song J, et al. Reprogramming of glucose metabolism: metabolic alterations in the progression of osteosarcoma[J/OL]. J Bone Oncol, 2024, 44: 100521[2024-07-02]. https://doi.org/10.1016/j.jbo.2024.100521.
[2] Mathew M, Nguyen N T, Bhutia Y D, et al. Metabolic signature of Warburg effect in cancer: an effective and obligatory interplay between nutrient transporters and catabolic/anabolic pathways to promote tumor growth[J/OL]. Cancers, 2024, 16(3): 504[2024-07-02]. https://doi.org/10.3390/cancers16030504.
[3] Hanahan D. Hallmarks of cancer: new dimensions[J]. Cancer Discov, 2022, 12(1): 31-46.
[4] Moraes B, Martins R, Lopes C, et al. G6PDH as a key immunometabolic and redox trigger in arthropods[J/OL]. Front Physiol, 2023, 14: 1287090[2024-07-02]. https://doi.org/10.3389/fphys.2023.1287090.
[5] Li R, Wang W, Yang Y, et al.Exploring the role of glucose-6-phosphate dehydrogenase in cancer (Review)[J]. Oncol Rep, 2020, 44(6): 2325-2336.
[6] Ahamed A, Hosea R, Wu S, et al. The emerging roles of the metabolic regulator G6PD in human cancers[J/OL]. Int J Mol Sci, 2023, 24(24): 17238[2024-07-02]. https://doi.org/10.3390/ijms242417238.
[7] Yang H, Chen D, Wu Y, et al. A feedback loop of PPP and PI3K/AKT signal pathway drives regorafenib-resistance in HCC[J/OL]. Cancer Metab, 2023, 11(1): 27[2024-07-02]. https://doi.org/10.1186/s40170-023-00311-5.
[8] Li Y, Tang S, Shi X, et al. Metabolic classification suggests the GLUT1/ALDOB/G6PD axis as a therapeutic target in chemotherapyresistant pancreatic cancer[J/OL]. Cell Rep Med, 2023, 4(9): 101162 [2024-07-02]. https://doi.org/10.1016/j.xcrm.2023.101162.
[9] Wang T, Dai L, Shen S, et al. Comprehensive molecular analyses of a macrophage-related gene signature with regard to prognosis, immune features, and biomarkers for immunotherapy in hepatocellular carcinoma based on WGCNA and the LASSO algorithm[J/OL]. Front Immunol, 2022, 13: 843408[2024-07-02]. https://doi.org/10.3389/fimmu.2022.843408.
[10] Wang X, Zhang J, Wu Y, et al. RORα inhibits gastric cancer proliferation through attenuating G6PD and PFKFB3 induced glycolytic activity[J/OL]. Cancer Cell Int, 2024, 24(1): 12[2024-07-02]. https://doi.org/10.1186/s12935-023-03201-4.
[11] Ge Z, Xu M, Ge Y, et al. Inhibiting G6PD by quercetin promotes degradation of EGFR T790M mutation[J/OL]. Cell Rep, 2023, 42(11): 113417[2024-07-02]. https://doi.org/10.1016/j.celrep.2023.113417.
[12] Li R, Ke M, Qi M, et al. G6PD promotes cell proliferation and dexamethasone resistance in multiple myeloma via increasing antioxidant production and activating Wnt/β-catenin pathway[J/OL]. Exp Hematol Oncol, 2022, 11(1): 77[2024-07-02]. https://doi.org/10.1186/s40164-022-00326-6.
[13] Vives Corrons J L, Colomer D, Pujades A, et al. Congenital 6-phosphogluconate dehydrogenase (6PGD) deficiency associated with chronic hemolytic anemia in a Spanish family[J]. Am J Hematol, 1996, 53(4): 221-227.
[14] Li C, Chen J, Li Y, et al. 6-Phosphogluconolactonase promotes hepatocellular carcinogenesis by activating pentose phosphate pathway[J/OL]. Front Cell Dev Biol, 2021, 9: 753196[2024-07-02]. https://doi.org/10.3389/fcell.2021.753196.
[15] Gillis J L, Hinneh J A, Ryan N K, et al. A feedback loop between the androgen receptor and 6-phosphogluoconate dehydrogenase (6PGD) drives prostate cancer growth[J/OL]. Elife, 2021, 10: e62592[2024-07-02]. https://doi.org/10.7554/elife.62592.
[16] Xu J, Ren G, Cheng Q. Inhibition of 6-phosphogluconate dehydrogenase reverses epirubicin resistance through metabolic reprograming in triple-negative breast cancer cells[J/OL]. Technol Cancer Res Treat, 2023, 22: 15330338231190737[2024-07-02].https://pmc.ncbi.nlm.nih.gov/articles/PMC10416659/. DOI: 10.1177/ 15330338231190737.
[17] Zara R, Rasul A, Sultana T, et al. Identification of Macrolepiota procera extract as a novel G6PD inhibitor for the treatment of lung cancer[J]. Saudi J Biol Sci, 2022, 29(5): 3372-3379.
[18] Chen H, Wu D, Bao L, et al. 6PGD inhibition sensitizes hepatocellular carcinoma to chemotherapy via AMPK activation and metabolic reprogramming[J/OL]. Biomed Pharmacother, 2019, 111: 1353-1358[2024-07-02]. https://doi.org/10.1016/j.biopha.2019.01.028.
[19] Shan C, Elf S, Ji Q, et al. Lysine acetylation activates 6-phosphogluconate dehydrogenase to promote tumor growth[J]. Mol Cell, 2014, 55(4): 552-565.
[20] Sun M, Li L, Niu Y, et al. PRMT6 promotes tumorigenicity and cisplatin response of lung cancer through triggering 6PGD/ENO1 mediated cell metabolism[J]. Acta Pharm Sin B, 2023, 13(1): 157-173.
[21] Liu R, Li W, Tao B, et al. Tyrosine phosphorylation activates 6-phosphogluconate dehydrogenase and promotes tumor growth and radiation resistance[J/OL]. Nat Commun, 2019, 10(1): 991[2024-07-02]. https://doi.org/10.1038/s41467-019-08921-8.
[22] Feng Q, Li X, Sun W, et al. Targeting G6PD reverses paclitaxel resistance in ovarian cancer by suppressing GSTP1[J/OL]. Biochem Pharmacol, 2020, 178: 114092[2024-07-02]. https://doi.org/10.1016/j.bcp.2020.114092.
[23] Song J, Sun H, Zhang S, et al. The multiple roles of glucose6-phosphate dehydrogenase in tumorigenesis and cancer chemoresistance[J/OL]. Life, 2022, 12(2): 271[2024-07-02]. https://doi.org/10.3390/life12020271.
[24] Poulain L, Sujobert P, Zylbersztejn F, et al. High mTORC1 activity drives glycolysis addiction and sensitivity to G6PD inhibition in acute myeloid leukemia cells[J]. Leukemia, 2017, 31(11): 2326-2335.
[25] Chen X, Xu Z, Zhu Z, et al. Modulation of G6PD affects bladder cancer via ROS accumulation and the AKT pathway in vitro[J]. Int J Oncol, 2018, 53(4): 1703-1712.
[26] Ghergurovich J M, Garcia-Canaveras J C, Wang J, et al. A small molecule G6PD inhibitor reveals immune dependence on pentose phosphate pathway[J]. Nat Chem Biol, 2020, 16(7): 731-739.
[27] Luo Z, Du D, Liu Y, et al. Discovery and characterization of a novel glucose-6-phosphate dehydrogenase (G6PD) inhibitor via highthroughput screening[J/OL]. Bioorg Med Chem Lett, 2021, 40: 127905[2024-07-02]. https://doi.org/10.1016/j.bmcl.2021.127905.
[28] Yamawaki K, Mori Y, Sakai H, et al. Integrative analyses of gene expression and chemosensitivity of patient-derived ovarian cancer spheroids link G6PD-driven redox metabolism to cisplatin chemoresistance[J/OL]. Cancer Lett, 2021, 521: 29-38[2024-07-02]. https://doi.org/10.1016/j.canlet.2021.08.018.
[29] Lv Y, Lv X, Zhang J, et al. BRD4 targets the KEAP1-Nrf2-G6PD axis and suppresses Redox metabolism in small cell lung cancer[J/OL].Antioxidants, 2022, 11(4): 661[2024-07-02]. https://doi.org/10.3390/antiox11040661.
[30] Huang C, Xu Y, Wang D, et al. Interference with Redox homeostasis through a G6PD-targeting self-assembled hydrogel for the enhancement of sonodynamic therapy in breast cancer[J/OL]. Front Chem, 2022, 10: 908892[2024-07-02]. https://doi.org/10.3389/fchem. 2022.908892.
[31] Mele L, La Noce M, Paino F, et al. Glucose-6-phosphate dehydrogenase blockade potentiates tyrosine kinase inhibitor effect on breast cancer cells through autophagy perturbation[J/OL]. J Exp Clin Cancer Res, 2019, 38(1): 160[2024-07-02]. https://doi.org/10.1186/s13046-019-1164-5.
[32] Bose S, Huang Q, Ma Y, et al.G6PD inhibition sensitizes ovarian cancer cells to oxidative stress in the metastatic omental microenvironment[J/OL]. Cell Rep, 2022, 39(13): 111012[2024-07-02]. https://doi.org/10.1016/j.celrep.2022.111012.
[33] Mele L, Paino F, Papaccio F, et al. A new inhibitor of glucose-6-phosphate dehydrogenase blocks pentose phosphate pathway and suppresses malignant proliferation and metastasis in vivo[J/OL]. Cell Death Dis, 2018, 9(5): 572[2024-07-02]. https://doi.org/10.1016/j. celrep.2022.111012.
[34] Thakor P, Subramanian R B, Thakkar S S, et al. Phytol induces ROS mediated apoptosis by induction of caspase 9 and 3 through activation of TRAIL, FAS and TNF receptors and inhibits tumor progression factor Glucose 6 phosphate dehydrogenase in lung carcinoma cell line (A549)[ J/OL]. Biomed Pharmacother, 2017, 92: 491-500[2024-07-02]. https://doi.org/10.1016/j.biopha.2017.05.066.
[35] Wang X, Wu G, Cao G, et al. Zoledronic acid inhibits the pentose phosphate pathway through attenuating the Ras-TAp73-G6PD axis in bladder cancer cells[J]. Mol Med Rep, 2015, 12(3): 4620-4625.
[36] Thakkar A B, Subramanian R B, Thakkar S S, et al. Biochanin A - A G6PD inhibitor: in silico and in vitro studies in non-small cell lung cancer cells (A549)[ J/OL]. Toxicol In Vitro, 2024, 96: 105785[2024-07-02]. https://doi.org/10.1016/j.tiv.2024.105785.
[37] Lin R, Elf S, Shan C, et al. 6-Phosphogluconate dehydrogenase links oxidative PPP, lipogenesis and tumour growth by inhibiting LKB1-AMPK signalling[J]. Nat Cell Biol, 2015, 17(11): 1484-96.
[38] Feng Q, Li X, Sun W, et al. Discovery of ebselen as an inhibitor of 6PGD for suppressing tumor growth[J/OL]. Cancer Manag Res, 2020, 12: 6921-6934[2024-07-02]. https://doi.org/10.2147/cmar.s254853.
[39] Khan G B, Qasim M, Rasul A, et al. Identification of lignan compounds as new 6-phosphogluconate dehydrogenase inhibitors for lung cancer[J/OL]. Metabolites, 2022, 13(1): 34[2024-07-02]. https://doi.org/10.3390/metabo13010034.
[40] Parsanathan R, Jain S K. Glucose-6-phosphate dehydrogenase deficiency increases cell adhesion molecules and activates human monocyte-endothelial cell adhesion: protective role of l-cysteine[J/OL]. Arch Biochem Biophys, 2019, 663: 11-21[2024-07-02]. https://doi.org/10.1016/j.abb.2018.12.023.
[41] Li R, Ke M, Qi M, et al. G6PD promotes cell proliferation and dexamethasone resistance in multiple myeloma via increasing antioxidant production and activating Wnt/β-catenin pathway[J/OL]. Exp Hematol Oncol, 2022, 11(1): 77[2024-07-02]. https://doi.org/10.1186/s40164-022-00326-6.
[42] Luo M, Fu A, Wu R, et al. High expression of G6PD increases doxorubicin resistance in triple negative breast cancer cells by Maintaining GSH Level[J]. Int J Biol Sci, 2022, 18(3): 1120-1133.
[43] Schwartz A G. Dehydroepiandrosterone, cancer, and aging[J]. Aging Dis, 2022, 13(2): 423-432.
[44] Di Monaco M, Pizzini A, Gatto V, et al. Role of glucose-6-phosphate dehydrogenase inhibition in the antiproliferative effects of dehydroepiandrosterone on human breast cancer cells[J]. Br J Cancer, 1997, 75(4): 589-592.
[45] Mercaldi G F, Ranzani A T, Cordeiro A T. Discovery of new uncompetitive inhibitors of glucose-6-phosphate dehydrogenase[J]. J Biomol Screen, 2014, 19(10): 1362-1371.
[46] 廖敏 , 强晓妍 , 盛泽娟 , 等 . 小分子靶向抗肿瘤药物耐药机制与应对策略 [J]. 药学进展, 2023, 47(9): 693-705.
[47] Liu B, Fu X, Du Y, et al. Pan-cancer analysis of G6PD carcinogenesis in human tumors[J]. Carcinogenesis, 2023, 44(6): 525-534.
[48] Wang C, Yu C, Chang H, et al. Glucose-6-phosphate dehydrogenase: a therapeutic target for ovarian cancer[J]. Expert Opin Ther Targets, 2023, 27(8): 733-743.
[49] Hao S, Meng Q, Sun H, et al. The role of transketolase in human cancer progression and therapy[J/OL]. Biomed Pharmacother, 2022, 154: 113607[2024-07-02]. https://doi.org/10.1016/j.biopha.2022. 113607
[50] Zhu Y, Zhang Y, Zhang Q, et al. Gambogic acid suppresses the pentose phosphate pathway by covalently inhibiting 6PGD protein in cancer cells[J]. Chem Commun, 2022, 58(64): 9030-9033.
美编排版:陈鑫茹
感谢您阅读《药学进展》微信平台原创好文,也欢迎各位读者转载、引用。本文选自《药学进展》2024年第 12 期。
《药学进展》杂志由国家教育部主管、中国药科大学和中国药学会共同主办,中国科技核心期刊(中国科技论文统计源期刊)。刊物以反映药学科研领域的新方法、新成果、新进展、新趋势为宗旨,以综述、评述、行业发展报告为特色,以药学学科进展、技术进展、新药研发各环节技术信息为重点,是一本专注于医药科技前沿与产业动态的专业媒体。
《药学进展》注重内容策划、加强组稿约稿、深度挖掘、分析药学信息资源、在药学学科进展、科研思路方法、靶点机制探讨、新药研发报告、临床用药分析、国际医药前沿等方面初具特色;特别是医药信息内容以科学前沿与国家战略需求相合,更加突出前瞻性、权威性、时效性、新颖性、系统性、实战性。根据最新统计数据,刊物篇均下载率连续三年蝉联我国医药期刊榜首,复合影响因子1.216,具有较高的影响力。
《药学进展》编委会由国家重大专项化学药总师陈凯先院士担任主编,编委由新药研发技术链政府监管部门、高校科研院所、制药企业、临床医院、CRO、金融资本及知识产权相关机构近两百位极具影响力的专家组成。
联系《药学进展》↓↓↓
编辑部官网:pps.cpu.edu.cn;
邮箱:yxjz@163.com;
电话:025-83271227。
欢迎投稿、订阅!
往期推荐
聚焦“兴药为民·2023生物医药创新融合发展大会”“兴药为民·2023生物医药创新融合发展大会”盛大启幕!院士专家齐聚杭城,绘就生物医药前沿赛道新蓝图“兴药强刊”青年学者论坛暨《药学进展》第二届青年编委会议成功召开“兴药为民·2023生物医药创新融合发展大会”路演专场圆满收官!校企合作新旅程已启航
我知道你在看哟
寡核苷酸临床2期核酸药物
分析
对领域进行一次全面的分析。
登录
或
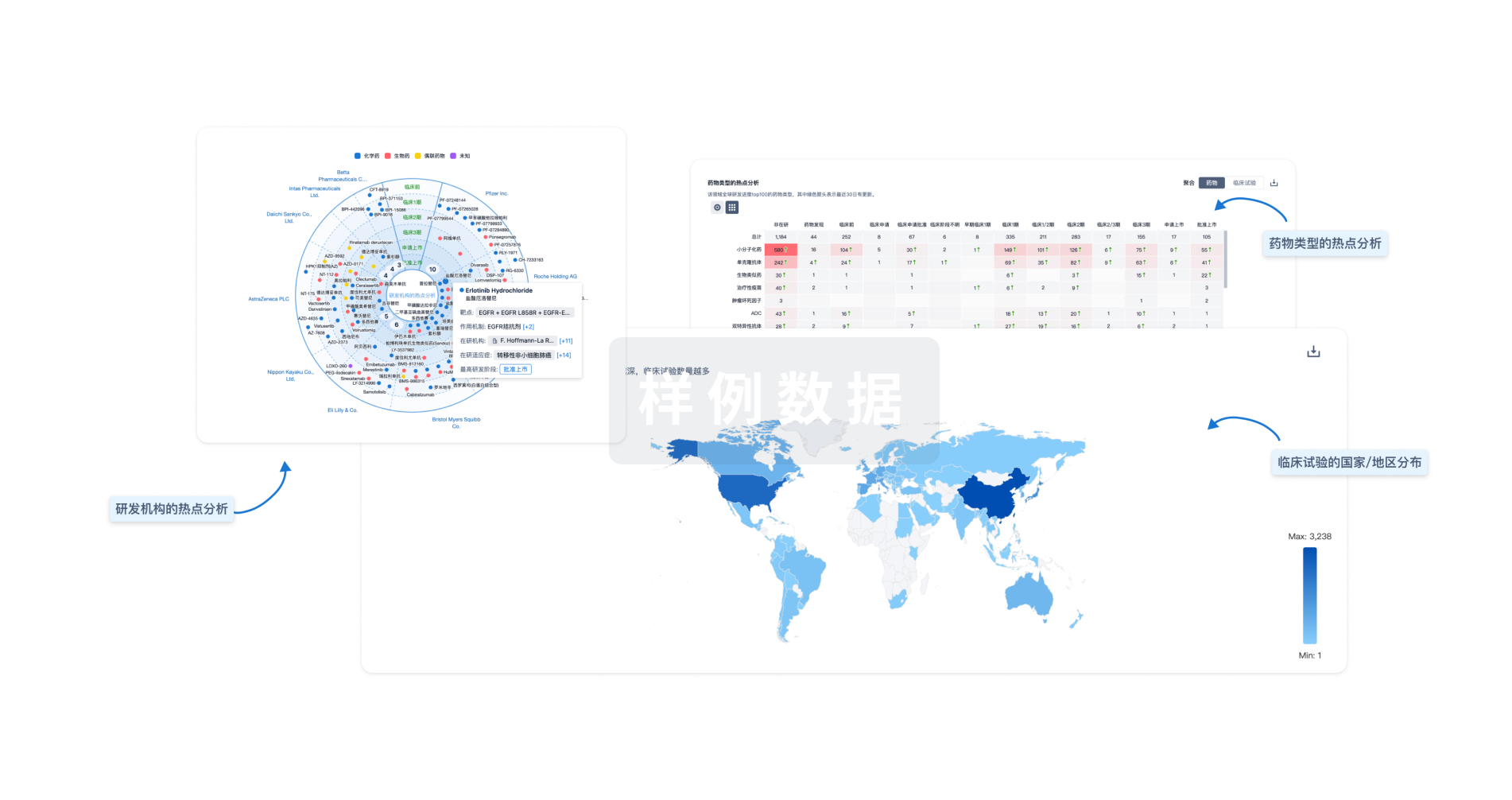
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用





