预约演示
肿瘤免疫治疗的新靶点:CXCR3及其配体
免疫疗法
前言
趋化因子是一类细胞分泌的细胞因子或信号蛋白,由于它们能够诱导附近应答细胞的定向趋化,因此被称为趋化细胞因子。趋化因子和趋化因子受体现已被证明影响许多细胞功能,包括生存、粘附、侵袭和增殖,并调节趋化因子水平,大多数恶性肿瘤表达一种或多种趋化因子受体。
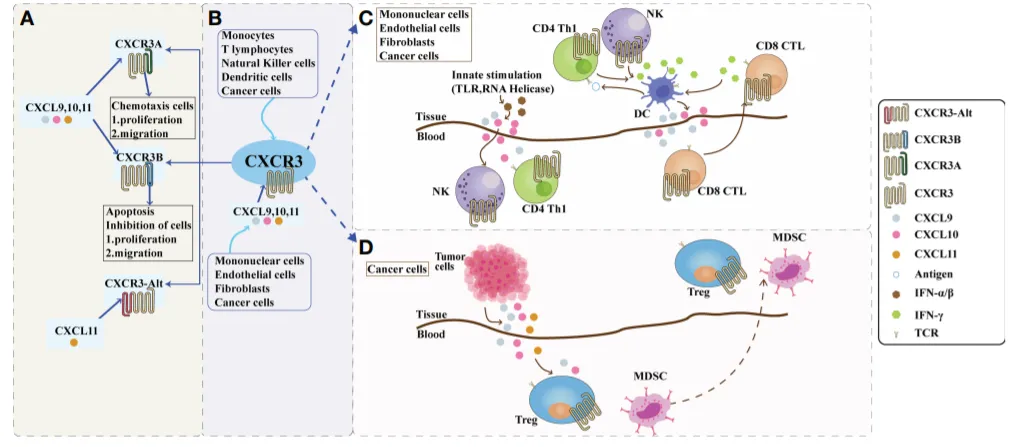
CXCR3及其配体的组成和作用
Preview
来源: 药时代
CXC趋化因子根据谷氨酸-亮氨酸-精氨酸(ELR)基序的存在与否分为两种形式:具有ELR基序的趋化因子促进中性粒细胞迁移和血管生成,而不具有ELR的趋化素促进淋巴细胞迁移并抑制血管生成。CXCL9、10和11是ELR阴性CXC趋化因子,可通过抑制血管生成从而抑制肿瘤生长。然而,也有人认为它促进肿瘤增殖和转移,可能是因为配体对不同的CXCR3变体发挥不同的作用。CXCL9、10和11主要调节CXCR3途径中的免疫细胞激活、分化和迁移,并通过招募免疫细胞发挥免疫应答作用。在免疫功能方面,CXCL9和CXCL10可以增强Th1细胞的效应器功能;然而,CXCL11与CXCR3受体上的不同位点结合,可以介导相反的效应器功能,促进分化的调节T细胞的表达,进而抑制效应器T细胞的功能。
小结
参考文献:
1.The role of CXCR3 and its ligands in cancer. Front Oncol.2022 Nov 21;12:1022688.
内容来源于网络,如有侵权,请联系删除。
机构
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


