预约演示
更新于:2025-05-07

Shorla Pharma Ltd.
更新于:2025-05-07
概览
标签
肿瘤
血液及淋巴系统疾病
免疫系统疾病
小分子化药
疾病领域得分
一眼洞穿机构专注的疾病领域
暂无数据
技术平台
公司药物应用最多的技术
暂无数据
靶点
公司最常开发的靶点
暂无数据
| 排名前五的药物类型 | 数量 |
|---|---|
| 小分子化药 | 6 |
| 排名前五的靶点 | 数量 |
|---|---|
| DHFR(二氢叶酸还原酶) | 1 |
| ADA(腺苷脱氨酶) | 1 |
| ABL x Bcr-Abl x PDGFRs x c-Kit | 1 |
| DNA | 1 |
关联
7
项与 Shorla Pharma Ltd. 相关的药物作用机制 ABL 抑制剂 [+3] |
在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期2001-05-10 |
靶点 |
作用机制 DHFR抑制剂 |
原研机构 |
在研适应症 |
非在研适应症 |
最高研发阶段批准上市 |
首次获批国家/地区 日本 |
首次获批日期1968-02-01 |
靶点 |
作用机制 DNA抑制剂 [+1] |
在研机构 |
非在研适应症- |
最高研发阶段批准上市 |
首次获批国家/地区 美国 |
首次获批日期1959-03-09 |
100 项与 Shorla Pharma Ltd. 相关的临床结果
登录后查看更多信息
0 项与 Shorla Pharma Ltd. 相关的专利(医药)
登录后查看更多信息
1
项与 Shorla Pharma Ltd. 相关的文献(医药)2020-08-01·Drug Discovery Today
3 tips for pharma startup success
作者: Cunningham, Sharon
26
项与 Shorla Pharma Ltd. 相关的新闻(医药)2025-04-29
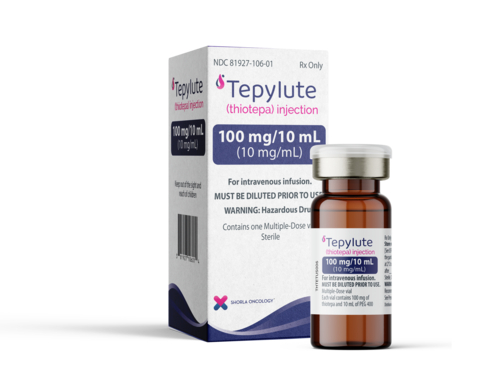
CAMBRIDGE, Mass.--(BUSINESS WIRE)--Shorla Oncology (‘Shorla’), a U.S.-Ireland specialty pharmaceutical company, announced today that the U.S. Food and Drug Administration has granted approval for 100 mg/10mL multi-dose vial of TEPYLUTE, a ready-to-dilute formulation of thiotepa to treat breast and ovarian cancer, that eliminates the need for reconstitution and may reduce preparation time and errors offering more scheduling flexibility for their patients.
Shorla Oncology Announces FDA Approval of TEPYLUTE® 100mg, First and Only Ready-to-Dilute Multi-Dose Vial of Thiotepa to Treat Breast and Ovarian Cancer and Commercial Launch of TEPYLUTE 15mg and 100mg Vials in the U.S.
“We are pleased to offer another viable treatment option for patients with breast and ovarian cancer,” said Sharon Cunningham, Chief Executive Officer and Co-Founder of Shorla Oncology. “Once opened, our 100mg vial of TEPYLUTE is stable for 14 days when properly stored, giving providers the flexibility they need when preparing and administering this very important treatment.
TEPYLUTE is a ready to dilute formulation of a well-established, standard of care oncology drug thiotepa that has been manufactured as freeze-dried powder since the 1950s.
“This is a huge win for providers because TEPYLUTE avoids the need for complicated and time-consuming reconstitution,” said Orlaith Ryan, Chief Technical Officer and Co-Founder of Shorla Oncology.
We are excited to bring TEPYLUTE to the US Market. It provides consistent dosing accuracy and allows for “just in time” preparation, which benefits everyone, especially patients.” said Rayna Herman, Chief Commercial Officer, Shorla Oncology.
The American Cancer Society estimates that more than 300,000 women will be diagnosed with breast cancer in the U.S in 2025.2 About 20,890 women will be diagnosed with ovarian cancer in the U.S. in 2025.3
About Shorla Oncology
Shorla Oncology is a privately- held, U.S. and Ireland- based commercial stage specialty pharmaceutical company established by Sharon Cunningham and Orlaith Ryan. The company has an advanced pipeline of innovative oncology drugs for orphan and pediatric cancers. Shorla is focused on indications where existing treatments are limited, in shortage or the drug applications are inadequate for the target population. The company’s growing portfolio brings accessible, affordable and life-saving treatments to patients, delivering a major contribution to patient care. Shorla currently markets three products, Nelarabine for the treatment of T-cell leukemia, JYLAMVO™ for the treatment of acute lymphoblastic leukemia and other indications and IMKELDI for the treatment of Chronic Myeloid Leukemia, Gastrointestinal Stromal Tumors (GISTs) and other indications.
For further information, please visit www.shorlaoncology.com.
TEPYLUTE® (thiotepa) Injection for Intravenous Use
INDICATION
TEPYLUTE is an alkylating drug indicated for the treatment of adenocarcinoma of the breast or ovary.
IMPORTANT SAFETY INFORMATION
WARNING: SEVERE MYELOSUPPRESSION and CARCINOGENICITY
• TEPYLUTE may cause severe marrow suppression, and high doses may cause marrow ablation with resulting infection or bleeding. Monitor hematologic laboratory parameters.
• TEPYLUTE should be considered potentially carcinogenic in humans.
CONTRAINDICATIONS
TEPYLUTE is contraindicated in patients with severe hypersensitivity to thiotepa and in concomitant use with live or attenuated vaccines.
WARNINGS AND PRECAUTIONS
Myelosuppression : For patients receiving TEPYLUTE for treatment of adenocarcinoma of the breast or adenocarcinoma of the ovary, if the bone marrow has been compromised by prior irradiation or chemotherapy, or is recovering from chemotherapy, the risk of severe myelosuppression with TEPYLUTE may be increased. Perform periodic complete blood counts during the course of treatment with TEPYLUTE. Provide supportive care for infections, bleeding, and symptomatic anemia. Inform patients of the possibility of developing low blood cell counts and the need for hematopoietic progenitor cell infusion. Instruct patients to immediately report to their healthcare provider if bleeding or fever occurs.
Hypersensitivity: Clinically significant hypersensitivity reactions, including anaphylaxis, have occurred following administration of thiotepa. If anaphylactic or other clinically significant allergic reaction occurs, discontinue treatment with TEPYLUTE, initiate appropriate therapy, and monitor until signs and symptoms resolve. Counsel patients on the signs and symptoms of hypersensitivity and to seek immediate emergency assistance if they develop any of these signs and symptoms.
Cutaneous Toxicity: TEPYLUTE and/or its active metabolites may be excreted in part via skin in patients receiving high-dose therapy. Treatment with TEPYLUTE may cause skin discoloration, pruritus, blistering, desquamation, and peeling that may be more severe in the groin, axillae, skin folds, in the neck area, and under dressings. Instruct patients to shower or bathe with water at least twice daily through 48 hours after administration of TEPYLUTE. Change the occlusive dressing and clean the covered skin at least twice daily through 48 hours after administration of TEPYLUTE. Change bed sheets daily during treatment. Skin reactions associated with accidental exposure to TEPYLUTE may occur. Wash the skin thoroughly with soap and water in case the TEPYLUTE solution contacts the skin. Flush mucous membranes in case of TEPYLUTE contact with mucous membranes.
Concomitant Use of Live and Attenuated Vaccines: Do not administer live or attenuated viral or bacterial vaccines to a patient treated with TEPYLUTE until the immunosuppressive effects have resolved.
Hepatic Veno-Occlusive Disease: Monitor by physical examination, serum transaminases, and bilirubin, and provide supportive care to patients who develop hepatic veno-occlusive disease.
Central Nervous System Toxicity: Fatal encephalopathy has occurred in patients treated with high doses of thiotepa. Other central nervous system toxicities, such as headache, apathy, psychomotor retardation, disorientation, confusion, amnesia, hallucinations, drowsiness, somnolence, seizures, coma, inappropriate behavior, and forgetfulness have been reported to occur in a dose-dependent manner during or shortly after administration of high-dose thiotepa. Do not exceed the recommended dose of TEPYLUTE. If severe or life-threatening central nervous system toxicity occurs, discontinue administration of TEPYLUTE and provide supportive care.
Carcinogenicity: Like many alkylating agents, thiotepa has been reported to be carcinogenic when administered to laboratory animals. Carcinogenicity is shown most clearly in studies using mice, but there is some evidence of carcinogenicity in man. There is an increased risk of secondary malignancy with the use of TEPYLUTE. Inform patients that TEPYLUTE can increase the risk of secondary malignancy.
Polyethylene glycol (PEG) 400 toxicity : TEPYLUTE contains a high concentration of PEG 400. Based on findings in animals, administration of high amounts of PEG 400 may cause damage to the kidneys and liver at dosages higher than recommended. When prescribing TEPYLUTE, take into consideration the PEG 400 load from concomitant medications.
Embryo-Fetal Toxicity: Based on the mechanism of action and findings in animals, TEPYLUTE can cause fetal harm when administered to a pregnant woman. There are no adequate and well-controlled studies of TEPYLUTE in pregnant women. Thiotepa given by the intraperitoneal (IP) route was teratogenic in mice at doses ≥1 mg/kg (3.2 mg/m 2 ), approximately 8-fold less than the maximum recommended human therapeutic dose (0.8 mg/kg, 27 mg/m 2 ), based on body-surface area. Thiotepa given by the IP route was teratogenic in rats at doses ≥3 mg/kg (21 mg/m 2 ), approximately equal to the maximum recommended human therapeutic dose, based on body-surface area. Thiotepa was lethal to rabbit fetuses at a dose of 3 mg/kg (41 mg/m 2 ), approximately two times the maximum recommended human therapeutic dose based on body-surface area. Advise pregnant women and females of reproductive potential of the potential risk to the fetus. Advise females of reproductive potential to use highly effective contraception during TEPYLUTE treatment and for 6 months after therapy/the last dose. Advise females of reproductive potential to inform their healthcare provider if they are pregnant or become pregnant. Advise males with female partners of reproductive potential to use effective contraception during TEPYLUTE treatment and for 1 year after therapy/the last dose.
ADVERSE REACTIONS
The most common adverse reactions (incidence greater than 10%) are neutropenia, anemia, thrombocytopenia, elevated alanine aminotransferase, elevated aspartate aminotransferase (AST), elevated bilirubin, mucositis, cytomegalovirus infection, hemorrhage, diarrhea, hematuria, and rash.
The clinically significant adverse reactions include myelosuppression, infection, hypersensitivity, cutaneous toxicity, hepatic veno-occlusive disease, central nervous system toxicity, and carcinogenicity.
DRUG INTERACTIONS
Effect of Cytochrome CYP3A Inhibitors and Inducers: In vitro studies suggest that thiotepa is metabolized by CYP3A4 and CYP2B6 to its active metabolite triethylene phosphoramide (TEPA). Avoid coadministration of strong CYP3A4 inhibitors (e.g., itraconazole, clarithromycin, ritonavir) and strong CYP3A4 inducers (e.g., rifampin, phenytoin) with thiotepa due to the potential effects on efficacy and toxicity. Consider alternative medications with no or minimal potential to inhibit or induce CYP3A4. If concomitant use of strong CYP3A4 modulators cannot be avoided, closely monitor for adverse drug reactions.
Effect of TEPYLUTE on Cytochrome CYP2B6 Substrates: In vitro studies suggest that thiotepa inhibits CYP2B6. Thiotepa may increase the exposure of drugs that are substrates of CYP2B6 in patients; however, the clinical relevance of this in vitro interaction is unknown. The administration of thiotepa with cyclophosphamide in patients reduces the conversion of cyclophosphamide to the active metabolite, 4‑hydroxycyclophosphamide; the effect appears sequence-dependent with a greater reduction in the conversion to 4-hydroxycyclophosphamide when thiotepa is administered 1.5 hours before the intravenous administration of cyclophosphamide compared to administration of thiotepa after intravenous cyclophosphamide. The reduction in 4-hydroxycyclophosphamide levels may potentially reduce the efficacy of cyclophosphamide treatment.
USE IN SPECIFIC POPULATIONS
Pregnancy: TEPYLUTE can cause fetal harm when administered to a pregnant woman based on findings from animals and the drug’s mechanism of action. Limited available data on thiotepa use in pregnant women are insufficient to inform a drug-associated risk of major birth defects and miscarriage. In animal reproduction studies, administration of thiotepa to pregnant mice and rats during organogenesis produced teratogenic effects (neural tube defects and malformations of the skeletal system of the fetus) at doses approximately 0.125 and 1 times, respectively, the maximum recommended human daily dose on a mg/m2 basis. Thiotepa was lethal to rabbit fetuses at approximately 2 times the maximum recommended human therapeutic dose based on body-surface area. Consider the benefits and risks of TEPYLUTE for the mother and possible risks to the fetus when prescribing TEPYLUTE to a pregnant woman.
Lactation: There is no information regarding the presence of thiotepa in human milk, the effects on the breastfed infant, or the effects on milk production. Because of the potential for serious adverse reactions, including the potential for tumorigenicity shown for thiotepa in animal studies, advise patients not to breastfeed during TEPYLUTE treatment and for 1 week after therapy/the last dose.
Females and Males of Reproductive Potential:
TEPYLUTE can cause fetal harm when administered to a pregnant woman.
Pregnancy Testing - Verify the pregnancy status of females of reproductive potential before initiating TEPYLUTE therapy.
Contraception for Females - Advise females of reproductive potential to avoid pregnancy during TEPYLUTE treatment and for 6 months after therapy/the last dose. Advise females to immediately report pregnancy.
Contraception for Males - TEPYLUTE may damage spermatozoa and testicular tissue, resulting in possible genetic abnormalities. Males with female sexual partners of reproductive potential should use effective contraception during TEPYLUTE treatment and for 1 year after therapy/the last dose.
Infertility - Based on nonclinical findings, male and female fertility may be compromised by treatment with TEPYLUTE. Advise patients that TEPYLUTE can produce infertility. Inform male patients about the possibility of sperm conservation before the start of therapy.
Pediatric Use: Safety and effectiveness of TEPYLUTE in neonates have not been established. Safety and effectiveness of TEPYLUTE for the treatment of adenocarcinoma of the breast and adenocarcinoma of the ovary in pediatric patients have not been established.
Geriatric Use: Clinical studies of thiotepa for treatment of adenocarcinoma of the breast and adenocarcinoma of the ovary did not include sufficient numbers of subjects aged 65 years and over to determine whether elderly subjects respond differently from younger subjects, and other reported clinical experience has not identified differences in responses between the elderly and younger patients. In general, dose selection for an elderly patient should be cautious, usually starting at the low end of the dosing range, reflecting the greater frequency of decreasing hepatic, renal, or cardiac function, and of concomitant disease or other drug therapy.
Renal Impairment: In patients with moderate (creatinine clearance [CLcr] of 30 mL/min to 59 mL/min) renal impairment, decreased renal excretion may result in increased plasma levels of thiotepa and TEPA. This may result in increased toxicity. Monitor patients with moderate to severe (CLcr <30 mL/min) renal impairment for signs and symptoms of toxicity following treatment with TEPYLUTE for an extended period of time.
Hepatic Impairment: Thiotepa is extensively metabolized in the liver. Patients with moderate (bilirubin levels greater than 1.5 times to 3 times the upper limit of normal and any AST) hepatic impairment may have increased plasma levels of thiotepa. This may result in toxicity. Monitor patients with moderate to severe (bilirubin levels greater than 3 times the upper limit of normal and any AST) hepatic impairment for signs and symptoms of toxicity following treatment with TEPYLUTE for an extended period of time.
To report suspected adverse reactions, contact Shorla Oncology at 1-844-668-3940 or FDA at 1-800-FDA-1088 or www.fda.gov/medwatch.
For Print: Please see the accompanying full Prescribing Information, including Boxed Warning.
For Digital: Please click here for full Prescribing Information, including Boxed Warning.
All trademarks are the property of Shorla Oncology. ©SHORLA ONCOLOGY® 2025. PRO-TEP-1377-v1 04/2025
上市批准临床结果
2024-12-10
·药事纵横
简要回顾11月份FDA批准新药的情况:
11月28日
产品:Applied
Therapeutics 的 Govorestat
适应症:半乳糖血症
在最初的目标行动日期三个月后,FDA 拒绝批准 Applied Therapeutics 的Govorestat 用于治疗罕见的遗传代谢疾病半乳糖血症。在其完整回复信中,监管机构列举了该公司临床应用中的“缺陷”。
在11月28日给投资者的一份报告中,William Blair分析师写道,Applied Therapeutics“怀疑”CRL“与疗效有关,而不是 [CMC] 或安全性”。
2023年4月公布的III期ACTION-半乳糖血症儿童研究结果表明,Govorestat 未达到其主要疗效终点,即旨在评估半乳糖血症症状各个领域的四项临床指标的综合终点。然而,据 Applied
Therapeutics称,在针对成人的I/II期ACTION-半乳糖血症研究中,用 Govorestat治疗导致半乳糖醇浓度下降。
FDA曾将Govorestat的初始目标日期定为8月28日,但在3月推迟了这一日期,称需要更多时间来审查补充提交。虽然该公司对被拒绝感到“失望”,但Applied
Therapeutics 公司首席执行官Soshana Shendelman在一份声明中表示,将计划“与FDA合作,解决CRL中的担忧,并确定Govorestat的快速前进道路”。
11月27日
产品:Orphan Pharmaceuticals 的 Rapiblyk
指示: 重症监护中的心颤
AOP Orphan
Pharmaceuticals 获得了FDA对 Rapiblyk的批准,用于治疗重症监护中的心房颤动。
Rapiblyk 设计为静脉内给药,是一种超短效肾上腺素能受体阻滞剂,已知其活性会影响心率。根据AOP的说法,Rapiblyk具有“快速起效”,导致心率快速下降,而不会显着抑制患者的血压。
FDA的决定得到了五项随机安慰剂对照试验结果的支持,这些试验共同表明,给药后10分钟内心率降低40%至90%,而安慰剂组为0%至11%。不良事件在 Rapiblyk 治疗患者中比在安慰剂中更常见。
Rapiblyk 旨在用于急诊和重症监护科,以及手术和重症监护环境。但它不适用于治疗慢性心律失常。
11月 25日
产品:Shorla Oncology 的 Imkeldi
指示: 多种类型的白血病和其他癌症
FDA批准了 Shorla Oncology 的Imkeldi,这是一种口服溶液,用于治疗多种类型的慢性粒细胞白血病和急性淋巴细胞白血病,以及其他癌症,如骨髓增生异常/骨髓增生性疾病、侵袭性系统性肥大细胞增多症和隆起性皮肤纤维肉瘤。
Imkeldi中的活性成分伊马替尼是一种酪氨酸激酶抑制剂,通过阻断 BCR-ABL蛋白起作用,进而防止癌细胞不受控制地生长并触发其死亡。它最初于2001年获得批准,由诺华以 Gleevec 作为片剂销售。
与其他形式的伊马替尼相比,Imkeldi的液体制剂提供了更好的剂量准确性,首席执行官 Sharon Cunningham表示,这可以“确保更精确和一致的剂量”。Cunningham补充说,对于吞咽药片困难或需要根据受影响体表面积使用特定剂量的患者,Imkeldi 可以提供“复合的便捷替代方案”。
根据 Shorla的说法,Imkeldi是 FDA 批准的第一个用于某些白血病的伊马替尼口服液体制剂。
11月 22日
产品: BridgeBio 的 Attruby
指示: 转甲状腺素蛋白淀粉样变性心肌病
对于 BridgeBio和转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)患者来说,感恩节来得很早,因为FDA在预定的PDUFA日期前一周批准了该公司的Attruby。
Attruby 的批准得到了III期ATTRibute-CM的积极结果的支持,其中转甲状腺素蛋白稳定剂显着减少了死亡和心血管相关住院,并改善了生活质量。
根据BridgeBio发布的新闻稿,Attruby 是“第一个也是唯一一个标签上写明 TTR 几乎完全稳定的获批产品”。分析人士一致认为,该药物的广泛标签(说明降低住院和死亡的可能性)将有助于其与辉瑞的Tafamidis 和 Alnylam的Amvuttra竞争,后者的补充新药申请已于周一被FDA接受。
11月 22日
产品:Amneal Pharmaceuticals 的艾塞那肽
指示: Ⅱ型糖尿病
FDA批准了 Amneal
Pharmaceuticals的艾塞那肽,与参比产品一样,Amneal 的仿制药适用于改善Ⅱ型糖尿病患者的血糖控制,并结合饮食和运动。仿制药艾塞那肽将提供1.2 mL和2.4mL预装注射笔。同样,这种仿制药与Byetta(属于阿斯利康)具有相同的不良反应,包括恶心、呕吐、头晕、腹泻和低血糖,以及其他常见的副作用。
Amneal 的艾塞那肽是“首批在美国获得批准的仿制药 GLP-1注射剂之一,”首席商务官 Andy Boyer 在一份声明中说。根据 Coherent Marketing Insights 的一份报告,到 2031年,GLP-1市场预计将达到557亿美元左右。目前,该领域由礼来和诺和诺德主导,它们分别销售Tirzepatide 和 Semaglutide,有效地垄断了GLP-1药物的糖尿病和肥胖市场。在美国以外,仿制药开发商已经开始威胁这些公司的利润,尤其是在中国和印度。
11月 21日
产品:Jazz 和 Zymeworks 的 Ziihera
指示: HER2 阳性胆道癌
随着FDA批准 Ziihera,Jazz Pharmaceuticals 和 Zymeworks 将与阿斯利康和第一三共针锋相对,后者的抗体-药物偶联物 Enhertu 于 2024年4月获得了与肿瘤无关的广泛批准。
Ziihera 是一种双特异性抗体,靶向HER2受体上的两个不重叠位点。这种独特的结合谱为 Ziihera 提供了多种作用机制,包括HER2信号传导的双重阻断和癌细胞表面HER2蛋白的去除。双特异性抗体还可以增强免疫系统的抗癌活性。
IIb期HERIZON-BTC-01研究数据报告称,接受 Ziihera 治疗的患者确认客观缓解率为41.3%,治疗缓解持续时间中位为12.9个月。至于安全性,中期试验发现 Ziihera 耐受性良好,只有两名患者因毒性而停止治疗。
Ziihera 已根据 FDA 的加速途径获得批准。为了保持其在市场上,Jazz和Zymeworks正在进行III 期HERIZON-BTC-302 验证性试验,该试验正在评估 Ziihera的一线治疗,联合化疗,联合或不联合 PD-(L)1抑制剂。
11月 20日
产品:UCB的Bimzelx
指示: 中度至重度化脓性汗腺炎
UCB 周三获得了FDA的批准,使用其皮下注射 Bimzelx(Bimekizumab-bkzx)治疗患有中度至重度化脓性汗腺炎的成年患者。
Bimzelx是一种人源化IgG1单克隆抗体,旨在靶向IL-17A和IL-17F细胞因子,已知它们在免疫和炎症级联反应中起关键作用。2023年10月,FDA 批准 Bimzelx用于患有中度至重度斑块状银屑病的成年患者,并于2024 年9月将其标签扩大到包括银屑病关节炎、强直性脊柱炎和非放射学中轴型脊柱关节炎。
该批准得到了两项 III 期研究——BE HEARD I 和 BE HEARD II 的数据的支持。综上所述,这些试验的结果表明,与安慰剂相比,更多接受Bimzelx治疗的患者在16周时化脓性汗腺炎的体征和症状至少改善了50%。这种治疗反应在48周的随访中得以维持。Bimzelx还在几个关键的次要结局中诱导了具有临床意义的改善。
据 UCB 称,Bimzelx 是第一个也是迄今为止唯一一个获批准的选择性阻断 IL-17A 和 IL-17A 的疗法。
11月 20日
产品:安斯泰来的Izervay
指示: 继发于年龄相关性黄斑变性(AMD)的地图样萎缩
FDA 周二拒绝了安斯泰来制药在其眼部注射剂 Izervay(Avacincaptad pegol 玻璃体内溶液)标签上包含两年数据的提议。
Izervay是一种聚乙二醇化寡核苷酸,通过靶向和禁用C5补体蛋白发挥作用,从而解决年龄相关性黄斑变性(AMD)的根本原因。它于 2023 年被批准用于治疗继发于 AMD 的地图样萎缩(GA),但其目前仅建议治疗长达12个月。
2024年4月,安斯泰来向FDA 提交了一份补充新药申请,寻求在 Izervay的标签中增加两年数据。该制药公司使用了III 期 GATHER2 试验的结果,该试验表明,与假对照相比,Izervay在 24 个月内继续减少GA病变的生长。在周二的完整回复信中,FDA重点关注安斯泰来提议的“与标签语言相关的统计问题”。两年来,监管机构没有发现Izervay的安全性或收益/风险状况存在任何问题。根据其新闻稿,该制药公司目前正在“寻求对拒绝的进一步澄清”,以期迅速解决 FDA的疑问。
11月 15日
产品:Syndax Pharmaceuticals 的 Revuforj
指示: 赖氨酸甲基转移酶 2A 基因易位的复发或难治性急性白血病
Syndax
Pharmaceuticals的Revuforj(Revumenib)成为市场上第一个用于治疗复发或难治性急性白血病的Menin抑制剂,当时 FDA 批准其用于携带赖氨酸甲基转移酶 2A (KMT2A)基因易位突变的成人或儿童患者。
在急性白血病中,KMT2A 基因重排与更具侵袭性的疾病有关,这些疾病的特点是复发率高和预后非常差。据 Syndax 称,在具有 KMT2A 重排突变的患者中,大约一半会在常规治疗后复发。几乎所有的 KMT2A 重排都被归类为易位突变,它产生与 Menin蛋白结合的融合蛋白,从而引发白血病的发展。
Revuforj 的批准得到了I/II 期 AUGMENT-101 研究中104名患者数据的支持,其中 21% 的接受治疗的患者达到完全缓解或完全缓解但血液学部分恢复。这种类型的治疗反应的中位持续时间为 6.4个月。
Syndax 预计将于本月在美国推出 110 mg和 160 mg的Revuforj片剂。同时,可用于年轻患者或体重低于40 kg的患者的25 mg剂量将于明年第一季度末或第二季度初上市。
11月 14日
产品:Azurity Pharmaceuticals 的Danziten
指示: 新诊断的费城染色体阳性慢性粒细胞白血病
Azurity
Pharmaceuticals获得了FDA对口服Danziten(尼罗替尼)的首个批准,没有用餐时间限制。
尼罗替尼是一种口服 BCR-ABL 激酶抑制剂,通过阻止癌细胞的生长和增殖起作用,进而诱导其死亡。尼罗替尼曾以品牌Tasigna获得批准,该商品名由诺华拥有和销售,适用于费城染色体阳性慢性粒细胞白血病。然而,根据Azurity的说法,Tasigna的生物利用度在与食物一起服用时会飙升,并可能导致心脏副作用。服用Tasigna的患者在服药前通常需要严格禁食,以避免这些毒性。作为一种解决方法,Azurity重新设计了尼罗替尼以生产 Danziten,其生物利用度比Tasigna更高,可以减少剂量并消除进餐时间限制的要求。
11月 12日
产品:Intercept Pharmaceuticals 的 Ocaliva
指示:原发性胆汁性胆管炎
在最初推迟了上个月的决定后,FDA 拒绝完全批准 Intercept
Pharmaceuticals 的 Ocaliva(奥贝胆酸)用于原发性胆汁性胆管炎(PBC)。
Ocaliva是一种类硒砜X受体激动剂,于2016年5月获得 FDA对PBC的加速批准。然而,在2024年9月,监管机构的胃肠道药物咨询委员会几乎一致投票反对这种口服药物,并指出Intercept没有提供足够的数据来支持Ocaliva的临床收益。在小组讨论前发布的一份简报文件中,FDA 的内部审查员表示,Ocaliva 在其一项验证性试验中“未能证明疗效”。
在周二的完整回复信中,FDA 表示,它正在继续审查其一项验证性研究中Ocaliva的安全数据。与此同时,Intercept声称,该药物仍将在其加速批准状态下提供给PBC患者。
11 月 8 日
产品:Autolus Therapeutics 的 Aucatzyl
指示:B 细胞急性淋巴细胞白血病
在FDA批准了用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(ALL)后,Aucatzyl 加入了已批准的CAR-T疗法名单。
Autolus 用 II 期FELIX 研究的数据支持Aucatzyl,该研究显示总体完全缓解率为63%,其中包括51%的患者达到完全缓解。Aucatzyl的优势在于它的安全性,细胞因子释放综合征和3级毒性的发生率较低,并且没有4级或5级不良事件。
“我们仍然相信 Aucatzyl更耐受的安全性将使其成为成人ALL患者的首选治疗选择,并随着时间的推移支持大多数市场份额,”William Blair 分析师 Matt Phipps 在周五的一份报告中表示。Aucatzyl 是第一个在没有风险评估缓解策略计划要求的情况下获得批准的 CAR- T疗法。
11月 4日
产品:Journey Medical的Emrosi
指示:酒糟鼻的炎性病变
“红斑痤疮是一种难以治疗的皮肤病,根据我们Ⅲ期临床试验的良好结果,Emrosi有可能成为治疗该病症的同类最佳口服药物,”总部位于亚利桑那州的Journey Medical首席执行官 Claude Maraoui 在一份声明中说。
Emrosi的批准得到了两项 III 期试验的支持,其中治疗达到所有共同主要和次要终点。据 Journey Medical 报道,Emrosi在两项试验中都显示出优于当前标准护理治疗(Oracea 40mg胶囊)和安慰剂的“统计学显着优势”,用于研究者的整体评估治疗成功和炎症病灶总数的减少。
Ref:https://www.biospace.com/biospace-fda-decision-tracker
药事纵横征稿启事
临床3期加速审批
2024-12-06
·精准药物
来源:药渡
撰文:幻目 编辑:维他命
到目前为止,FDA在2024年已经批准了一些重磅新药,包括礼来公司治疗阿尔茨海默病的Kisunla和Madrigal制药公司治疗代谢功能障碍相关脂肪性肝炎的Rezdiffra,BMS的35年来第一种新型精神分裂症药物KarXT等……相关内容拓展:35年来首款!FDA批准BMS新型精神分裂症药物,5款新药紧随其后……
11月又有一些新药获批,以下汇总了11月FDA批准的药物相关信息。
1
Rapiblyk
研发企业:AOPOrphan Pharmaceuticals
适应症:重症监护中的心房颤动和心房扑动
总部位于维也纳的AOPOrphan Pharmaceuticals获得了FDA对Rapiblyk(兰地洛尔)的批准,用于治疗重症监护环境中的心房颤动和心房扑动。Rapiblyk设计为静脉内给药,是一种超短效肾上腺素能受体拮抗剂,Rapiblyk可以“快速起效”,导致心率快速下降,而不会显著抑制患者的血压。
FDA的批准得到了五项随机安慰剂对照试验结果的支持,这些试验共同表明,给药后10分钟内患者心率降低40%至90%,而安慰剂组为0%至11%。不良事件在Rapiblyk治疗患者中比在安慰剂中更常见。Rapiblyk旨在用于急诊和重症监护科,以及手术和重症监护环境,它不适用于治疗慢性心律失常。
2
Imkeldi
研发企业:Shorla Oncology
适应症:几种形式的白血病和其他癌症
FDA批准了Shorla Oncology的Imkeldi,是FDA批准的第一个用于某些白血病的伊马替尼口服液体制剂。用于治疗某些类型的慢性粒细胞白血病和急性淋巴细胞白血病,以及其他癌症,如骨髓增生异常/骨髓增生性疾病、侵袭性系统性肥大细胞增多症和隆起性皮肤纤维肉瘤。
Imkeldi中的活性成分伊马替尼是一种酪氨酸激酶抑制剂,通过阻断BCR-ABL蛋白起作用,进而防止癌细胞不受控制地生长并触发其死亡。它最初于2001年获得批准,由诺华以Gleevec品牌作为片剂销售。与固体制剂相比,Imkeldi的液体制剂提供了更好的剂量准确性,对于吞咽药片困难或需要使用特定剂量的患者,Imkeldi可以提供便捷替代方案。
3
Attruby
研发企业:BridgeBio
适应症:转甲状腺素蛋白淀粉样变性心肌病
FDA批准了Attruby,用于治疗患有转甲状腺素蛋白淀粉样变性心肌病(ATTR-CM)的成年人,以减少心血管死亡和心血管相关的住院治疗。Attruby是第一个也是唯一一个药物标签上标明转甲状腺素蛋白(TTR)接近完全稳定(≥90%)的药物。
Attruby的批准得到了III期ATTRibute-CM的积极结果的支持,其中转甲状腺素蛋白稳定剂显著减少了死亡和心血管相关住院事件,并改善了生活质量。
4
仿制药艾塞那肽
研发企业:Amneal Pharmaceuticals
适应症:2型糖尿病
FDA批准Amneal Pharmaceuticals的艾塞那肽(阿斯利康Byetta的仿制药),利润丰厚且竞争激烈的GLP-1领域迎来了一个新仿制药。
与Byetta一样,Amneal的仿制药适用于改善2型糖尿病患者的血糖控制。仿制药艾塞那肽将提供1.2mL和2.4mL预装笔。同样,这种仿制药与Byetta具有相同的不良反应,包括恶心、呕吐、头晕、腹泻和低血糖,以及其他常见的副作用。
Amneal的艾塞那肽是“首批在美国获得批准的GLP-1注射剂仿制药之一,首席商务官AndyBoyer在一份声明中说,到2031年,GLP-1市场预计将达到557亿美元左右。目前,该领域由礼来和诺和诺德主导,它们分别销售tirzepatide和semaglutide,有效地垄断了GLP-1药物的糖尿病和肥胖市场。
5
Ziihera
研发企业:Jazz & Zymeworks
适应症:HER2阳性胆道癌
JAZZ宣布FDA加速批准Ziihera®(zanidatamab-hrii)用于治疗无法切除或转移性HER2阳性(IHC3+)胆道癌(BTC)的成人患者。
Ziihera是一种双特异性抗体,靶向HER2受体上的两个不重叠位点。这种独特的结合谱为Ziihera提供了多种作用机制,包括HER2信号传导的双重阻断和癌细胞表面HER2蛋白的去除。双特异性抗体还可以增强免疫系统的抗癌活性。
加速批准得到了IIb期HERIZON-BTC-01研究数据的支持,该研究报告称,接受Ziihera治疗的患者确认客观缓解率为41.3%,治疗缓解持续时间中位为12.9个月。安全性方面,中期试验发现Ziihera耐受性良好,只有两名患者因毒性而停止治疗。
验证性、全球性、随机性3期试验HERIZON-BTC-302(NCT06282575)正在进行中,该试验正在评估zanidatamab与标准疗法联合治疗与单独使用标准治疗在HER2阳性BTC患者一线治疗中的疗效。Ziihera的继续获批可能取决于此次验证性试验中临床益处的验证和描述。
Zanidatamab还在针对其他多种肿瘤类型进行研究,包括针对胃食管腺癌(GEA)和转移性乳腺癌(mBC)的3期试验。
6
Bimzelx
研发企业:UCB
适应症:中度至重度化脓性汗腺炎
Bimzelx是一种人源化IgG1单克隆抗体,旨在靶向IL-17A和IL-17F细胞因子,它们在免疫和炎症级联反应中起关键作用。2023年10月,FDA批准Bimzelx用于患有中度至重度斑块状银屑病的成年患者,并于2024年9月将其标签扩大到包括银屑病关节炎、强直性脊柱炎和中轴型脊柱关节炎。11月批准用于中度至重度化脓性汗腺炎治疗。
此次批准得到了两项III期研究——BEHEARDI和BEHEARDII的数据的支持。这些试验的结果表明,与安慰剂相比,接受Bimzelx治疗的患者在16周时化脓性汗腺炎的体征和症状至少改善了50%,并且这种治疗反应在48周的随访中得以维持。此外,Bimzelx还在几个关键的次要研究终点中有临床意义的改善。
Bimzelx是第一个也是迄今为止唯一一个获批准的选择性阻断IL-17A和IL-17A的疗法。
7
Revuforj(revumenib)
研发企业:Syndax Pharmaceuticals
适应症:赖氨酸甲基转移酶2A基因易位的复发或难治性急性白血病
FDA批准Revuforj用于携带赖氨酸甲基转移酶2A(KMT2A)基因易位突变的成人或儿童患者,使其成为市场上第一个用于治疗复发或难治性急性白血病的menin抑制剂。
KMT2A基因重排(KMT2Ar)可能会导致侵袭性急性白血病,其预后极差且复发率高。据估计,超过95%的KMT2Ar急性白血病患者携带KMT2A易位,超过一半的KMT2Ar急性白血病患者在接受传统一线治疗后会复发,其中位总生存期(OS)不到一年。在接受三线或后续治疗时,仅5%的患者可达到完全缓解,其中位OS不足三个月。
Revuforj的批准得到了I/II期AUGMENT-101研究中104名患者数据的支持,其中21%接受治疗的患者达到完全缓解或部分血液学恢复。这种类型的治疗反应的中位持续时间为6.4个月。
Syndax预计将于本月在美国推出110毫克和160毫克的Revuforj片剂。同时,可用于年轻患者或体重低于40公斤的患者的25毫克剂量将于明年第一季度末或第二季度初上市。
8
Danziten尼洛替尼
研发企业:Azurity Pharmaceuticals
适应症:新诊断的费城染色体阳性慢性粒细胞白血病
FDA批准了第一种也是唯一一种不限制进餐时间的尼洛替尼片Danziten。
尼洛替尼是一种口服BCR-ABL激酶抑制剂,通过阻止癌细胞的生长和增殖起作用,进而诱导其死亡。Tasigna是诺华公司的尼洛替尼片,在国内名为达希纳,该药物于2010年被批准用于治疗新诊断的慢性期成年患者。该药物的处方信息规定患者在治疗前2小时和治疗后1小时内应禁食。因为Tasigna的生物利用度在与食物一起服用时会飙升,并可能导致心脏副作用。服用Tasigna的患者在服药前通常需要严格禁食,以避免这些毒性。作为一种解决方法,Azurity重新设计了尼洛替尼Danziten,其生物利用度比Tasigna更高,可以减少剂量并消除进餐时间限制的要求。
9
Aucatzyl
研发企业:Autolus Therapeutics
适应症:B细胞急性淋巴细胞白血病
在FDA批准用于治疗成人复发或难治性B细胞急性淋巴细胞白血病(ALL)后,Aucatzyl加入了FDA批准的CAR-T疗法名单。
II期FELIX研究的数据支持Aucatzyl获批,该研究显示总体完全缓解率为63%,其中包括51%的患者达到完全缓解。Aucatzyl的优势在于安全性,细胞因子释放综合征和3级毒性的发生率较低,并且没有4级或5级不良事件。
Aucatzyl是第一个在没有风险评估缓解策略计划要求的情况下,获得批准的CAR-T疗法。Aucatzyl安全性将使其成为成人ALL患者的首选治疗选择。
10
Emrosi
研发企业:Journey Medical
适应症:酒渣鼻的炎性病变
FDA批准治疗酒渣鼻炎症病变的口服药物Emrosi。此次批准得到了两项III期试验的支持,其中治疗达到所有主要和次要终点。Emrosi在两项试验中都显示出优于当前标准护理治疗(Oracea40毫克胶囊)和安慰剂。Emrosi有可能成为治疗该病症的同类最佳口服药物。
参考资料:
https://www.biospace.com/biospace-fda-decision-tracker
声明:发表/转载本文仅仅是出于传播信息的需要,并不意味着代表本公众号观点或证实其内容的真实性。据此内容作出的任何判断,后果自负。若有侵权,告知必删!
长按关注本公众号
粉丝群/投稿/授权/广告等
请联系公众号助手
觉得本文好看,请点这里↓
上市批准临床3期
100 项与 Shorla Pharma Ltd. 相关的药物交易
登录后查看更多信息
100 项与 Shorla Pharma Ltd. 相关的转化医学
登录后查看更多信息
组织架构
使用我们的机构树数据加速您的研究。
登录
或

管线布局
2026年02月28日管线快照
管线布局中药物为当前组织机构及其子机构作为药物机构进行统计,早期临床1期并入临床1期,临床1/2期并入临床2期,临床2/3期并入临床3期
申请上市
2
3
批准上市
其他
2
登录后查看更多信息
药物交易
使用我们的药物交易数据加速您的研究。
登录
或

转化医学
使用我们的转化医学数据加速您的研究。
登录
或

营收
使用 Synapse 探索超过 36 万个组织的财务状况。
登录
或

科研基金(NIH)
访问超过 200 万项资助和基金信息,以提升您的研究之旅。
登录
或

投资
深入了解从初创企业到成熟企业的最新公司投资动态。
登录
或

融资
发掘融资趋势以验证和推进您的投资机会。
登录
或

生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。
生物序列数据库
生物药研发创新
免费使用
化学结构数据库
小分子化药研发创新
免费使用



