阿斯利康BTK抑制剂阿可替尼胶囊新适应症在国内获批上市,治疗血液肿瘤
2023年9月1日,中国国家药品监督管理局(NMPA)正式批准阿斯利康(AstraZeneca)血液肿瘤产品康可期(英文商品名:Calquence,通用名:阿可替尼胶囊)又一新适应症上市,单药适用于既往至少接受过一种治疗的成人慢性淋巴细胞白血病(CLL)/小淋巴细胞淋巴瘤(SLL)患者。此前,该药已于今年3月在中国获批,用于既往至少接受过一种治疗的成人套细胞淋巴瘤(MCL)患者。
阿可替尼是阿斯利康自主开发的第二代选择性BTK抑制剂,通过与BTK共价结合抑制其活性。在B细胞中,BTK信号导致B细胞增殖、转运、趋化和粘附所需的途径激活。临床前实验表明,该产品具有对BTK较高的亲和力和特异性。2017年10月,,阿可替尼获得美国FDA的加速批准,用于二线治疗套细胞淋巴瘤(MCL)。2019年11月,阿可替尼再次获得FDA批准,作为初始疗法或后续疗法治疗慢性淋巴性白血病(CLL)或小细胞淋巴瘤(SLL)成人患者。2023年3月,阿可替尼胶囊在中国获批用于MCL,商品名为康可期。2022年12月,阿可替尼第2项适应症在华申报上市,用于治疗复发或难治性慢性淋巴细胞白血病(CLL)患者。
此次阿可替尼新适应症的获批是基于全球3期ASCEND研究及中国1/2期关键研究的积极结果。其中,ASCEND研究探索了阿可替尼单药治疗复发/难治性CLL患者的有效性及安全性,试验共纳入310例中位年龄为67岁的患者。根据研究人员在2022年美国临床肿瘤学会(ASCO)年会和欧洲血液学(EHA)年会上公布的数据,中位随访46.5个月(约4年)的结果显示,接受阿可替尼治疗的患者在4年里显示出持续的无进展生存期(PFS)获益(基于研究者评估),42个月PFS率和总生存(OS)率分别为62%和78%。最终分析时阿可替尼将患者的死亡或进展风险显著降低72%,且不良事件风险较低,具有长期稳定的安全性。
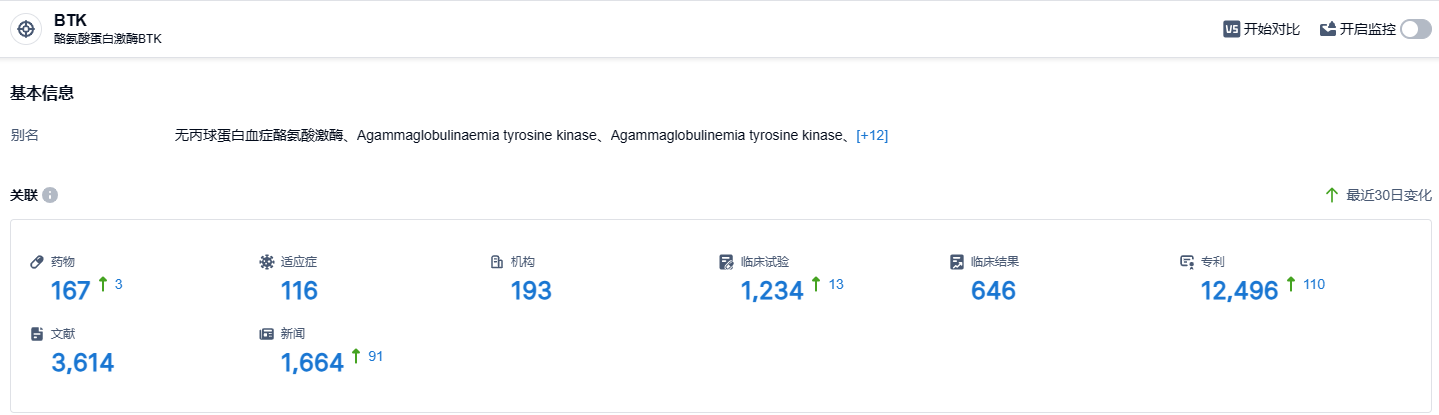
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 BTK靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年9月2日,BTK靶点共有在研药物167个,包含的适应症有116种,在研机构193家,涉及相关的临床试验1234件,专利多达12496件……目前,全球已有6款BTK抑制剂上市,除阿可替尼外,另外5款分别为伊布替尼(艾伯维/强生)、泽布替尼(百济神州)、奥布替尼(诺诚健华/渤健)和tirabrutinib(小野制药/吉利德)、pirtobrutinib(礼来,BTK C481S抑制剂)。阿可替尼新适应症在国内获批,有助于使其市场销售额得到提升。