扩大至6-11岁患儿,阿斯利康IL-5Rα单抗benralizumab再获FDA批准
2024年4月11日,阿斯利康(AstraZeneca)的IL-5Rα单抗Fasenra(benralizumab)获美国FDA批准扩大适用人群,用于6至11岁嗜酸性粒细胞表型严重哮喘患者的附加维持治疗。
benralizumab是最初由协和麒麟开发的一种人源化的抗IL-5Rα单克隆抗体,具有抗嗜酸性粒细胞活性。缺乏聚焦(afocusylation)增加了其对CD16a的亲和力,并显著增强了NK细胞介导的抗体依赖性细胞介导的细胞毒性(ADCC)。2006年12月,MedImmune与协和麒麟达成协议,获得benralizumab在美国、欧洲和其它国家的商业化权益。2007年4月,阿斯利康以156亿美元收购MedImmune,将其管线中的45款在研产品收入囊中。2016年10月,阿斯利康扩大benralizumab的商业化权益至日本。2019年3月,阿斯利康与协和麒麟达成新的许可协议,获得benralizumab在亚洲地区的开发和商业化权益以及全球商业化权益。2023年12月26日,据CDE官网,阿斯利康Benralizumab注射液获批临床,拟用于≥12岁的青少年及成人嗜酸粒细胞性重度哮喘患者的维持药物的减药治疗。
2017年11月,benralizumab首次在美国获批上市,商品名为Fasenra,用于12岁及以上的重症嗜酸性粒细胞性哮喘患者的附加维持治疗。嗜酸性粒细胞性哮喘是哮喘的一种亚型,人类认识它已经超过100年,它通常成年发病,且往往症状严重,难以控制,甚至对高剂量激素也反应不佳。嗜酸性哮喘影响整个呼吸道,从鼻窦到远端气道。嗜酸性粒细胞性哮喘患者经常合并鼻息肉和慢性鼻窦炎。2019年10月,FDA批准了患者可自行注射的预填充一次性自动注射笔(FASENRA Pen™)。
此次扩大适用人群的批准是基于一项开放标签、多国、非随机、平行分组的III期TATE试验以及在成人和青少年人群中进行的充分且控制良好的试验的证据的支持。在TATE研究中,Fasenra达到了主要终点,其在6至11岁SEA患儿中的药代动力学(PK)和药效学(PD)与之前的试验一致。Fasenra的安全性和耐受性也与该药物已知概况一致。
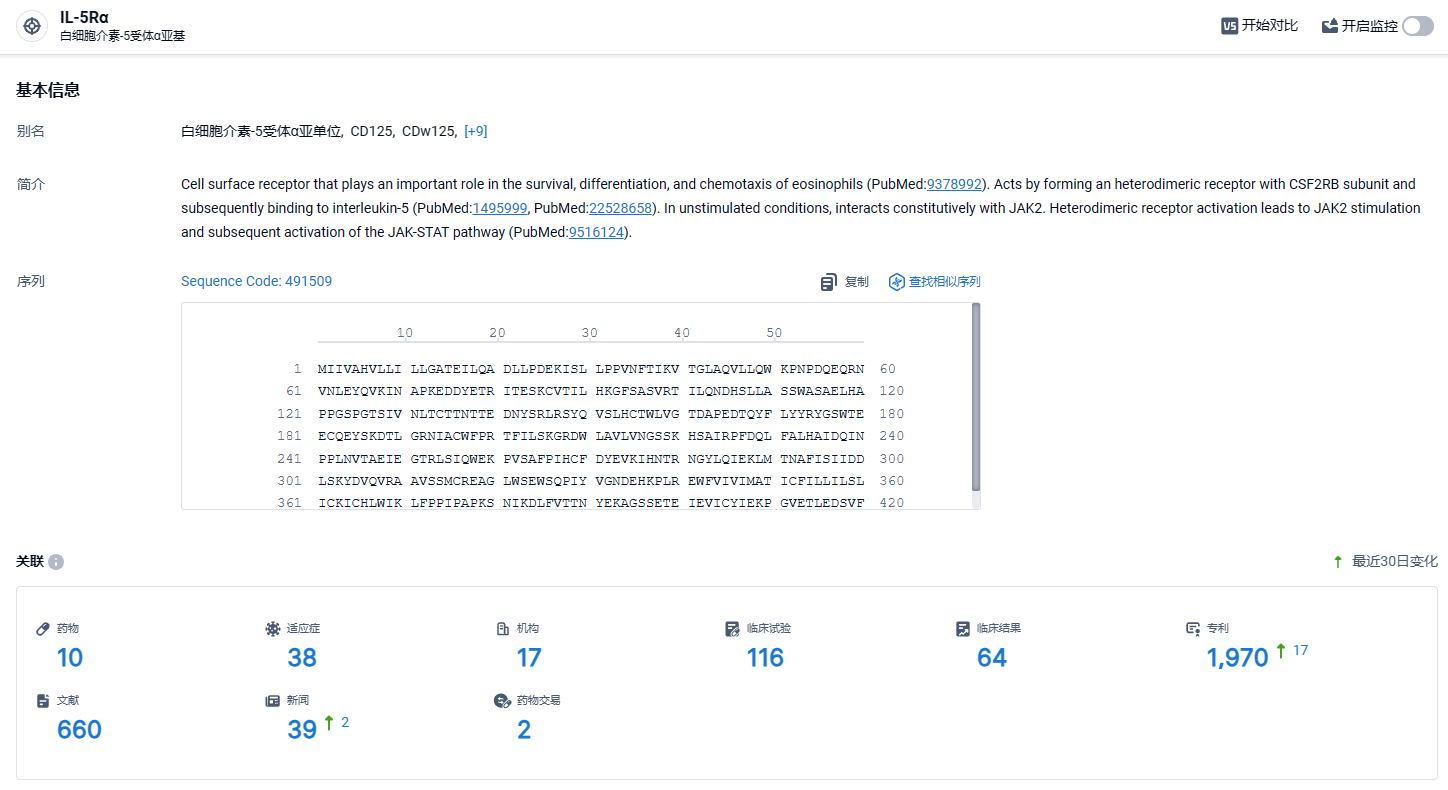
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达IL-5Rα靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年4月13日,IL-5Rα靶点共有在研药物10个,包含的适应症有38种,在研机构17家,涉及相关的临床试验116件,专利多达1970件……期待这款IL-5Rα单抗能够早日在国内上市,给国内患者带来新的治疗选择。