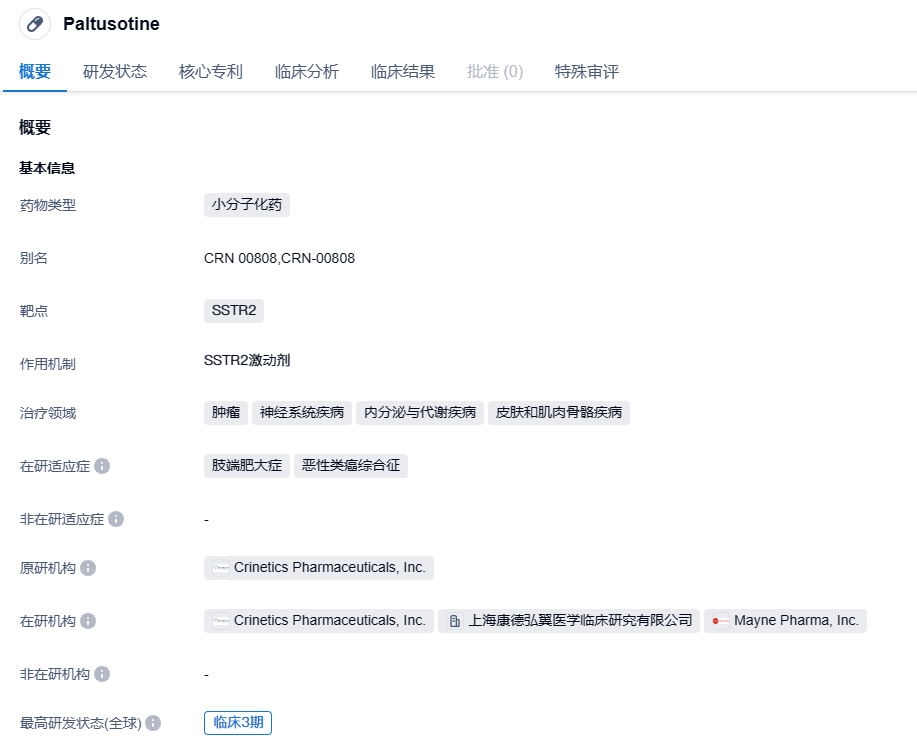
Crinetics公布SST2激动剂paltusotine 即将递交上市申请,治疗肢端肥大症
2024年3月19日,Crinetics Pharmaceuticals宣布PATHFNDR-2临床3期试验的积极顶线结果,该试验评估其每日一次口服在研疗法paltusotine用以治疗肢端肥大症(acromegaly)患者的疗效与安全性。该试验达成主要终点与所有次要终点,此积极结果支持Crinetics预计于2024年下半年所递交的新药申请(NDA)。
近日,Crinetics Pharmaceuticals公司公布了其口服、每日一次的在研化合物paltusotine治疗肢端肥大症患者的3期临床试验PATHFNDR-1的积极数据。该研究达到了主要终点和所有次要终点。
paltusotine是一种新型口服非肽类可溶性生长抑素2型(SSTR2)受体激动剂,可抑制健康志愿者中的生长激素(GH)和胰岛素样生长因子-1(IGF-1)水平,且耐受性良好。Crinetics公司正在开发该药用于治疗肢端肥大症和神经内分泌肿瘤患者。早先,该药已经获美国FDA授予治疗肢端肥大症的孤儿药资格。2022年8月,paltusotine获批在中国开展临床试验,可用于治疗对手术或放疗反应不足,或不适用于这些治疗的肢端肥大症患者。
ATHFNDR-2是评估paltusotine的第二项3期临床试验。该随机双盲试验在111名未曾接受药物治疗的肢端肥大症受试者中进行,以评估paltusotine与安慰剂相比的疗效与安全性。分析显示,该试验达成主要终点,接受paltusotine治疗患者(56%)24周后达到胰岛素样生长因子1(IGF-1)水平≤正常值上限(xULN)1.0倍的比例显著高于安慰剂组(5%,p<0.0001)。在PATHFNDR-2试验中,paltusotine总体耐受性良好,接受paltusotine治疗的受试者没有报告严重不良事件。在paltusotine治疗组和安慰剂组中,受试者出现至少一种治疗伴发不良事件(TEAE)的频率相当。
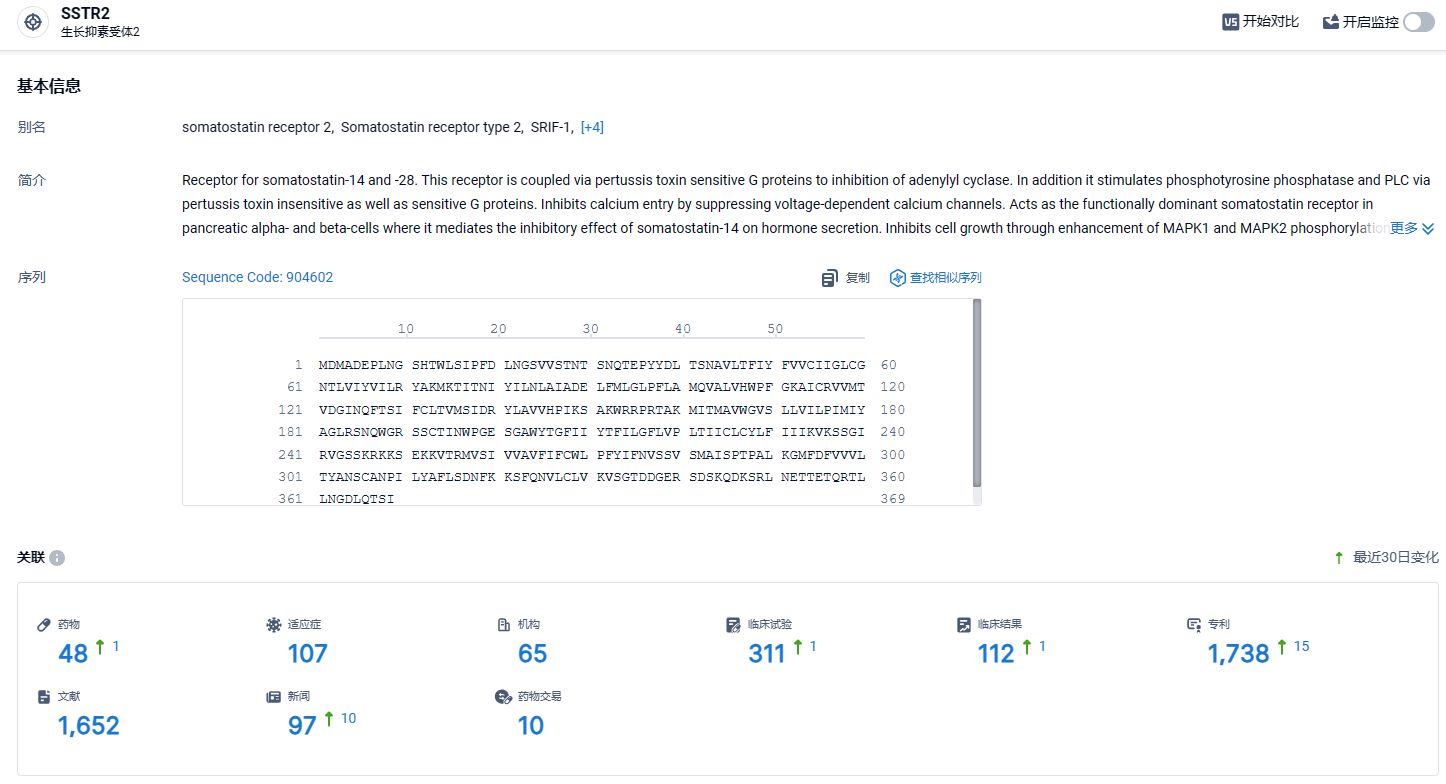
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 SSTR2靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024 年3月21日,SSTR2靶点共有在研药物46个,包含的适应症有107种,在研机构65家,涉及相关的临床试验311件,专利多达1738件……肢端肥大症是由垂体瘤导致生长激素过量分泌引起的,在美国影响了超过2.4万人。Crinetics在2024一季度获得第二项肢端肥大症三期临床的结果,并即将递交上市申请,期待paltusotine能够早日上市。