特瑞思CD20靶向ADC注射用TRS005拟纳入突破性治疗品种,针对淋巴瘤
2024年3月18日,中国国家药监局药品审评中心(CDE)官网公示,特瑞思递交的注射用TRS005拟被纳入突破性治疗品种,针对的适应症为至少经过2次标准治疗的复发或难治性CD20阳性弥漫大B细胞淋巴瘤。
TRS005是由浙江特瑞思药业股份有限公司自主研发的抗CD20-ADC药物,获得国家“十二五”和“十三五”重大新药创制专项资金滚动支持,非临床实验结果表明其疗效优异,1/8剂量即可达到与利妥昔单抗一致的肿瘤抑制效果。这个月初刚被CDE获准开展单臂2期临床试验。基于目前已获得的安全性及有效性数据,CDE同意该关键单臂2期临床试验支持TRS005附条件批准上市。
在2022年9月举行的欧洲肿瘤内科学会(ESMO)年会上,研究人员口头报告了TRS005的1期临床研究数据。有效性数据显示:45例可评估患者的总客观缓解率(ORR)为42.2%,其中完全缓解(CR)率为11.1%;弥漫性大B细胞淋巴瘤(DLBCL)、滤泡性淋巴瘤(FL)、套细胞淋巴瘤(MCL)、边缘区淋巴瘤(MZL)和淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)的ORR分别为52.9%、26.3%、60.0%、66.7%和0%;0.5、1.0、1.5和1.8mg/Kg剂量组的ORR分别为42.9%、33.3%、43.8%和50.0%,1.8 mg/Kg剂量组ORR(CR为14.3%,PR为35.7%)和疾病控制率(DCR)(85.7%)均为最高。研究认为,1a/1b期临床试验数据表明,TRS005在复发/难治性B细胞非霍奇金淋巴瘤中显示出良好的疗效和可控的安全性。
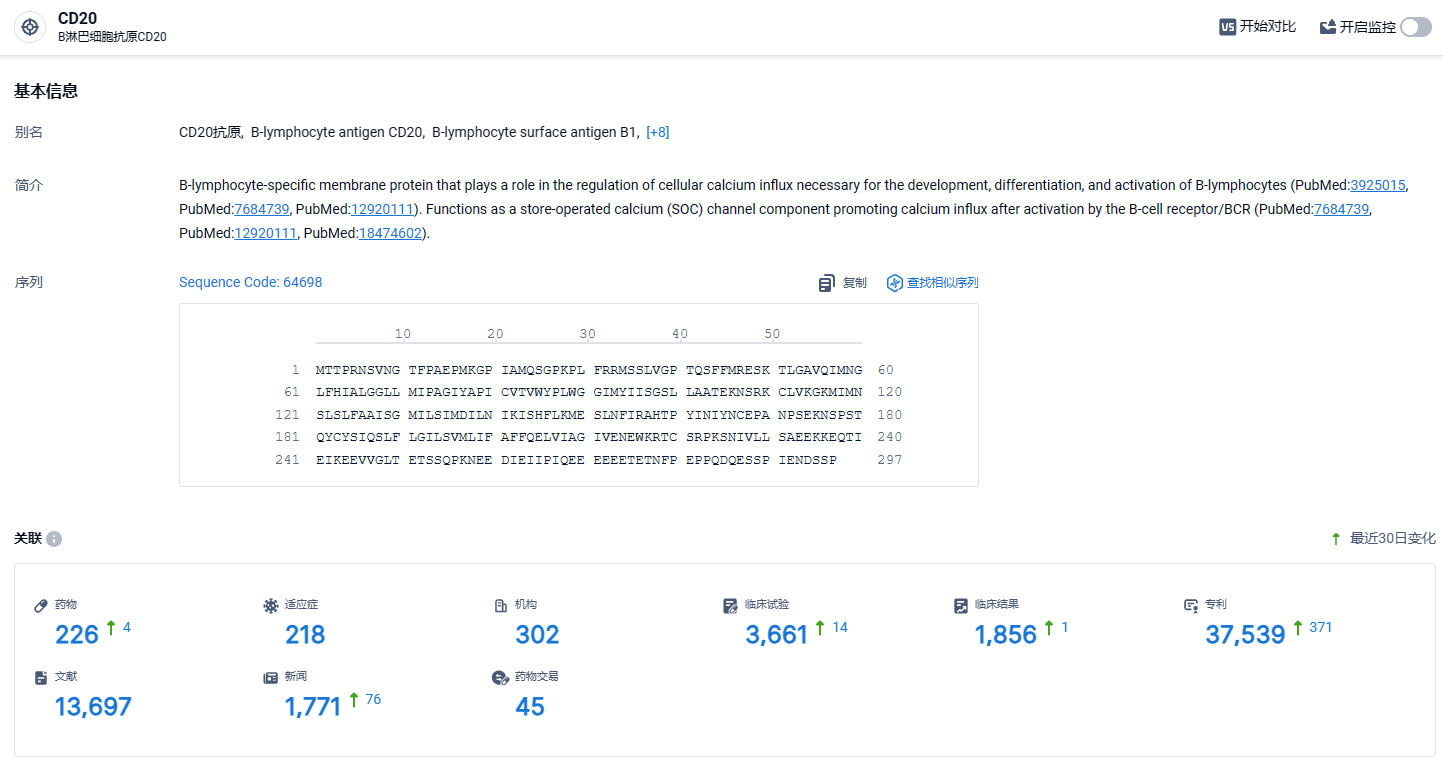
根据智慧芽新药情报库所披露的信息 (点击下方图片直达CD20靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2024年3月20日,CD20靶点共有在研药物226个,包含的适应症有218种,在研机构302家,涉及相关的临床试验3661件,专利多达37539件……TRS005在靶点选择方面,在高度同质化的ADC赛道上,避开了当时较为热门的HER-2、c-Met, Trop2等靶点,转而选择了CD20靶点。期待TRS005在内卷的ADC领域脱颖而出。




