FCN-159——口服高效选择性MEK1/2抑制剂
FCN-159是一种口服高效选择性MEK1/2抑制剂,是BRAF突变或RAS突变肿瘤的候选靶向治疗药物,它的选择性比曲美替尼高 10 倍。FCN-159是由重庆复创医药研究有限公司(复星医药子公司)开发,主要用于治疗遗传病与畸形、肿瘤,当前正在开发多种适应症,其中组织细胞瘤于2023年4月13日,首次获得NMPA突破性疗法认证;2023年7月17日,针对NF1突变型丛状神经纤维瘤,再次获得NMPA突破性疗法认证。 FCN-159未来很可能上市,并为患者提供新的治疗选择和希望。
研发状态
经查询“智慧芽新药情报库”,现阶段该药物布局的适应症包括NF1突变型丛状神经纤维瘤(神经纤维瘤病1型)、低级神经胶质瘤、动静脉畸形、胶质瘤、组织细胞瘤、黑色素瘤、丛状神经纤维瘤、Erdheim-Chester病、郎格罕细胞组织细胞增生症等,均已进入临床试验阶段。 其中研发进展最快的为NF1突变型丛状神经纤维瘤、低级神经胶质瘤,当前在中国已进入临床3期;神经纤维瘤病1型在全球多个国家开展临床试验,在中国、美国、意大利、西班牙、波兰已进入临床2期。除此之外,有关动静脉畸形、胶质瘤、组织细胞瘤、黑色素瘤、丛状神经纤维瘤的研究也已进入临床2期。获得突破性疗法认证的组织细胞瘤的最新研究是2022年4月,在中国启动的一项介入性、开放标签、单组分配、多中心II期试验(ChiCTR230067955;CTR2221069),旨在评估FCN-159治疗组织细胞增多症患者的药代动力学、疗效和安全性。主要终点是客观有效率。该试验预计将于2025年12月完成。更多研发状态信息、核心专利、临床分析等详细数据,请点击下方图片链接获取。
本次获得NMPA突破性疗法认证的适应症具体为:无法手术或术后残留/复发的NF1相关的丛状神经纤维瘤成人患者。表明与现有治疗手段相比有足够证据表明FCN-159具有明显临床优势。该适应症当前已进入临床3期,未来有很大可能获批上市。NF1突变型丛状神经纤维瘤是一种由于NF1基因突变引起的常染色体显性遗传的疾病。这个基因在正常情况下,其表达的蛋白质可抑制细胞的增长和分裂,基因发生突变后,表达出的蛋白丧失抑制功能,导致一系列的症状,其中包括皮肤上出现大小不等的黑色斑点,神经纤维瘤(良性肿瘤)的生长等。患者通常在儿童时期就会出现症状。
核心临床试验数据
神经纤维瘤病1型:在NCT04954001临床1/2期研究中,共有82名受试者接受FCN-159治疗,主要终点是客观缓解率(Objective response rate,ORR),次要终点是严重不良事件的发生率和治疗相关性不良事件的发生率。结果显示,ORR为31.7%(95%可信区间:21.9%~42.9%)。严重不良事件的发生率为1.2%。因不良事件需要停止治疗的比例为12.2%,因不良事件需要减少剂量的比例为9.8%。治疗相关≥3级不良事件的发生率分别为:毛囊炎25.6%,甲周炎4.9%。
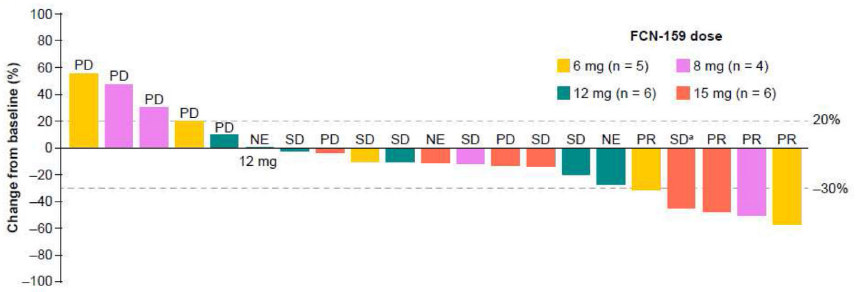
NRAS突变的晚期黑色素瘤:临床1a期试验NCT03932253显示33名患者被纳入9个FCN-159剂量组(0.2-15 mg QD)。共发生一起DLT事件:15 mg组出现3级毛囊炎。一起病因不明的死亡(与FCN-159无关)。最常见的FCN-159相关TEAE是皮疹(36.4%),≥3级FCN-159相关TEAE的发生率为15.2%;QD剂量<6 mg时的抗肿瘤活性有限;因此,疗效数据仅针对≥6mg的剂量(n=21)。客观缓解率和临床获益率分别为19.0%(4个部分缓解)和52.4%。中位(95%置信区间)反应持续时间和无进展生存期分别为4.8个月(2.8个月未达到)和3.8个月(1.8-5.6个月)。FCN-159暴露剂量成比例增加;几何平均终末半衰期为29.9-56.9小时。 给予FCN-159治疗后肿瘤应答结果见下图。