Zenocutuzumab——靶向HER2/HER3的双特异性抗体
Zenocutuzumab是由Merus NV开发的一款靶向HER2/HER3的双特异性抗体,最早于2023年07月07日在美国获批,用于治疗NRG1融合阳性非小细胞肺癌。2023年07月07日,针对NRG1融合阳性非小细胞肺癌,美国FDA将Zenocutuzumab纳入突破性疗法认证。
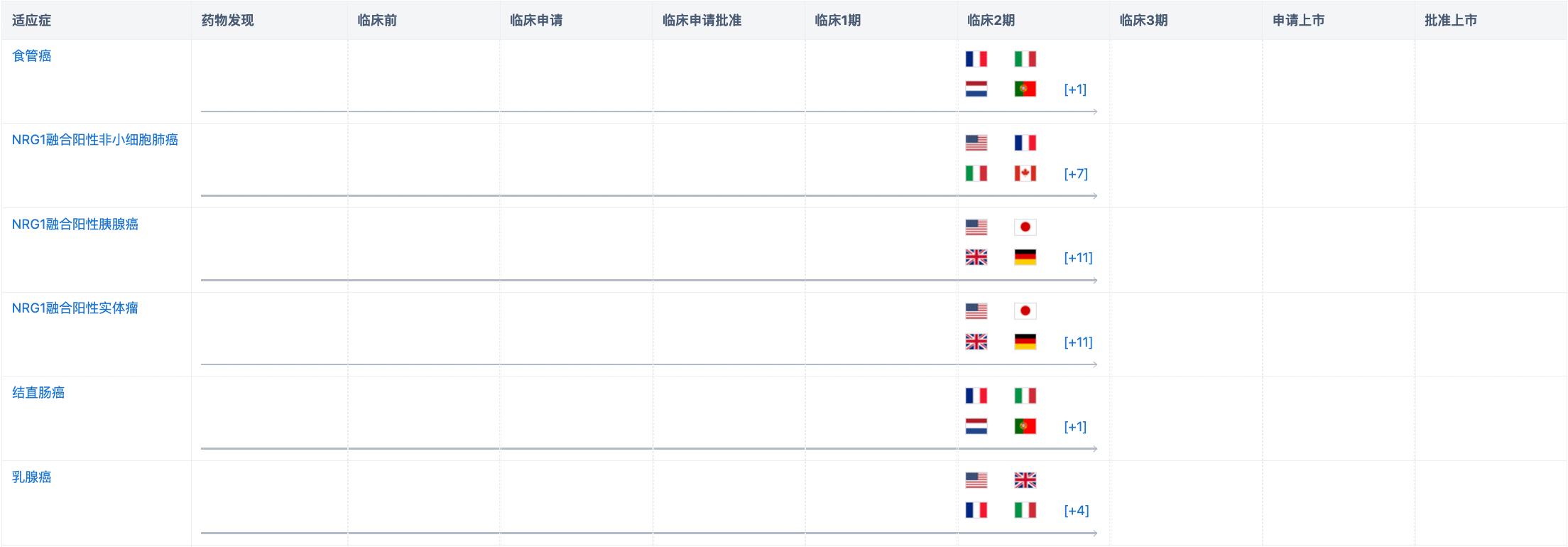
研发状态
经查询“智慧芽新药情报库”,现阶段该药物布局的适应症包括乳腺癌、NRG1融合阳性胰腺癌、NRG1融合阳性实体瘤、食管癌、NRG1融合阳性非小细胞肺癌、结直肠癌、胃癌、子宫内膜癌、卵巢癌。该药物目前在全球的最高研发阶段为临床2期,涉及食管癌、结直肠癌、乳腺癌等大多数适应症。更多机构信息、管线布局、营收等信息,请点击下方图片链接获取。
该药物虽然尚处于临床2期阶段,但已获得多个特殊审评认证,最初是在2020.07.22,针对胰腺癌获得美国FDA孤儿药认证,之后在2023.06.30,针对NRG1融合阳性胰腺癌,获得FDA突破性疗法认证,本次是第二个突破性疗法认证,针对的是NRG1融合阳性非小细胞肺癌。该认证指定是FDA基于NCT02912949、NCT04100694突出的临床试验结果做出的。
作用机制
NRG1融合是一个新兴的泛癌种靶点,存在于多种癌症类型中。NRG1重排是实体瘤复发的驱动因素之一,NRG1与HER3结合,使与其他HER/ERBB激酶异二聚化,增加下游信号传导和肿瘤发生。Zenocutuzumab是一种抗体依赖性的、具有增强的细胞毒性的HER2/HER3双特异性抗体,可抑制HER3和AKT的磷酸化,诱导凋亡标志物的表达,抑制细胞增长。
核心临床试验
NRG1融合阳性实体瘤:在NCT02912949临床2期研究中,主要终点是调查者评估的客观缓解率(ORR),次要终点是总缓解期(DOR)。结果显示,接受zenocutuzumab治疗的受试者,ORR为34,DOR的中位数为9.1个月 。表明无论肿瘤组织学类型, zenocutuzumab对NRG1融合阳性的癌症患者展示出了强大和持久的疗效,并且zenocutuzumab具有良好的耐受性。
NRG1阳性胰腺癌:在NCT02912949临床2期研究中,接受zenocutuzumab治疗的胰腺癌受试者,调查者评价的客观缓解率(ORR)为40% 。整体的ORR为27%。胰腺癌的疾病控制率(DCR)为90%。不良事件(3级)的比例不超过5%。
转移性乳腺癌:在NCT02912949临床2期研究中,接受zenocutuzumab治疗的胰腺癌受试者,调查者评价的ORR为40% 。整体ORR为27%。胰腺癌的疾病控制率(DCR)为90%。
竞争格局
据统计,当前有13款管线药物涉及HER2 + HER3,其中发展最快的为 Exelixis, Inc. 开发的多靶点药物泰西伐替尼(Tesevatinib),目前已进入临床3期,但靶点多,特异性差,适应症重合率小,Zenocutuzumab主要的同类竞品为阿斯利康开发的Sapitinib,靶点为EGFR + HER2 + HER3,同样进入临床2期,当前布局的适应症较少,主要为结直肠癌。更多详细数据,请点击下方图片链接获取。