呋喹替尼——靶向VEGFR1、VEGFR2、VEGFR3的小分子化药
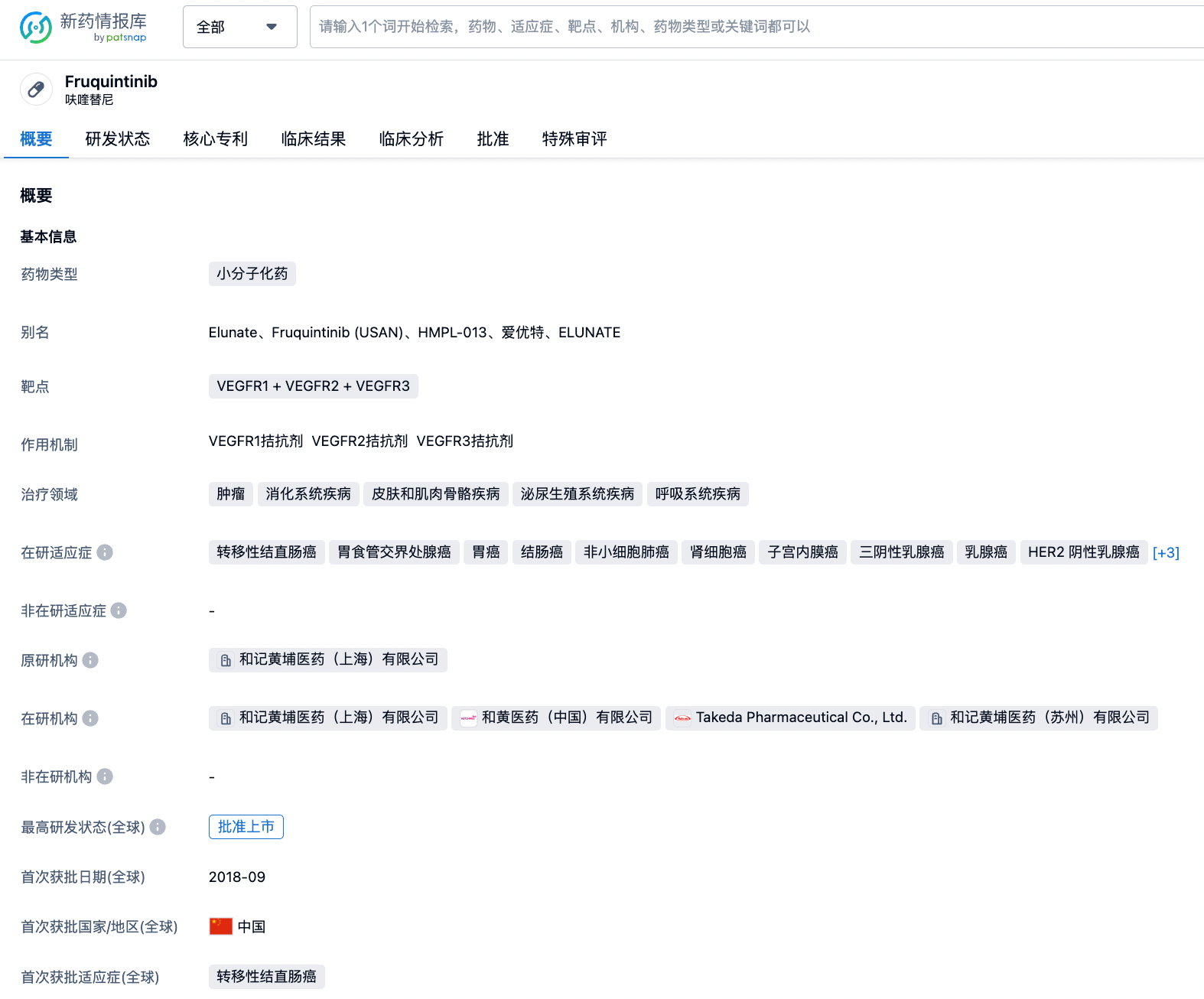
呋喹替尼胶囊,英文名称Fruquintinib,是一款靶向VEGFR1、VEGFR2、VEGFR3的小分子化药。该药物最初由和记黄埔医药(上海)有限公司研发,2023年1月23日,与Takeda(武田制药)子公司达成独家许可协议,武田制药将取得呋喹替尼在除中国内地、香港及澳门以外的全球范围的针对所有适应症的开发及商业化独家许可,和记黄埔将获得总额可高达11.3亿美元的付款(4亿美元首付款)。该药物最早于2018年09月04日在中国获批,用于治疗既往接受过氟嘧啶、奥沙利铂和伊立替康治疗的转移性结直肠癌患者。2022年03月01日在中国澳门获批。2023年07月10日,针对子宫内膜癌,NMPA将呋喹替尼纳入突破性疗法认证。
研发状态
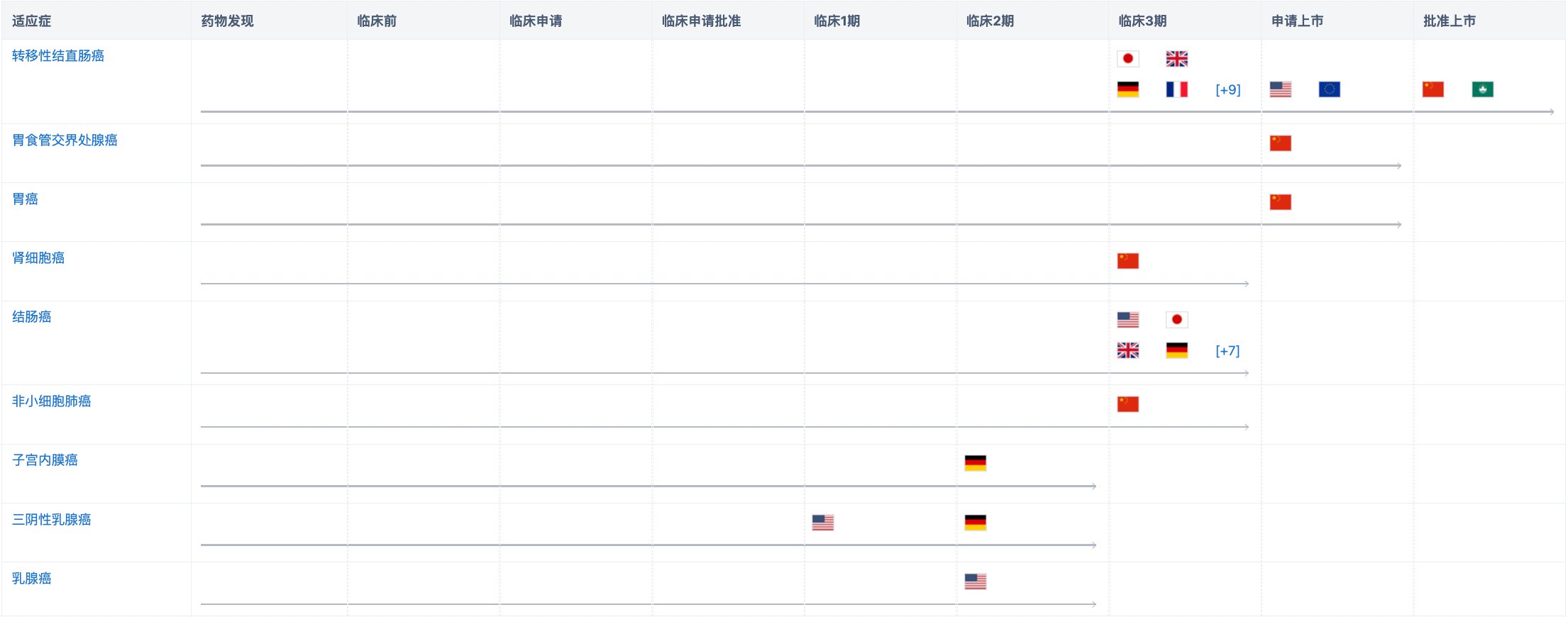
经查询“智慧芽新药情报库”,现阶段该药物布局的适应症包括转移性结直肠癌、胃食管交界处腺癌、胃癌、结肠癌、非小细胞肺癌、肾细胞癌、子宫内膜癌、三阴性乳腺癌、乳腺癌、HER2阴性乳腺癌、HR阳性乳腺腺癌以及转移性乳腺癌、直肠癌等。其中转移性结直肠癌除在中国获批外,在欧、美已递交上市申请,在日、英、德等13个国家处于临床3期(2023年也将在日本完成上市申请的递交);此外,和记黄埔还针对胃癌、胃食管交界处腺癌,已向EDC递交上市申请;关于子宫内膜癌的研究,目前正在开展临床3期试验。更多机构信息、管线布局、营收等信息,请点击下方图片链接获取。
除本次NMPA的突破性疗法认证外,早在2017年、2020年针对结直肠癌分别获得优先审评(中国)、快速通道(美国)认证,今年5月,因转移性结直肠癌获得优先审评(美国)。
临床试验结果
难治性结直肠癌:在临床3期研究(NCT04322539,FRESCO-2)中,Fruquintinib+最佳支持治疗(BSC)组的的OS为7.4个月,安慰剂+BSC组为4.8个月。
转移性结直肠癌:在临床3期研究(NCT02314819,FRESCO)中,Fruquintinib组的CEA应答率为30.0%,而安慰剂组为1.3%。Fruquintinib组的OS为9.3个月,而安慰剂组的OS为6.6个月。这两项研究的结果进一步支持了Fruquintinib在治疗难治性肿瘤方面的潜在价值。更多临床试验结果, 请点击下方图片链接获取。
安全性
在NCT04322539中,Fruquintinib+BSC组与安慰剂+BSC组,在3级或更高级别的特别关注不良事件(Adverse Events of Special Interest,AESIs)中的对比结果为:高血压(14.0% : 0.9%)、肝功能异常(8.3% : 9.1%)、皮肤毒性(6.8% : 0.4%)和感染(6.6% : 5.7%)的表现。由于AESIs原因中止治疗的受试者比例为8.3% : 6.1%; 由AESIs原因减少剂量的受试者比例为13.6% : 0.9%;AESIs发生率为80.7% : 53.0%。死亡率为1.8% : 1.3%。