FDA加速批准吉利德小分子疗法PPARδ激动剂Seladelpar,治疗原发性胆汁性肝硬化
8月15日,吉利德科学(Gilead Sciences)宣布,美国FDA已加速批准Livdelzi(seladelpar)与熊去氧胆酸(UDCA)联合用于治疗对UDCA应答不足的原发性胆汁性肝硬化(PBC)成人患者,或作为单药治疗对UDCA不耐受的患者,但不建议患有或发展为失代偿性肝硬化的患者使用Livdelzi。根据新闻稿,Livdelzi是在碱性磷酸酶(ALP)正常化、关键生物标志物和瘙痒控制方面,与安慰剂相比表现出统计学显著改善的首个疗法。
Seladelpar是一种强效、选择性、口服PPARδ激动剂,可调节高度未满足医疗需求的适应症中的关键代谢和肝脏疾病途径。PPARδ可以在肝脏中的多种细胞中表达,包括肝细胞,胆管细胞,库普佛细胞和星状细胞。PPARδ参与并影响了多种生理过程,包括脂肪代谢,葡萄糖代谢平衡,炎症等等。临床前和临床数据显示, seladelpar具有参与调节胆汁酸合成、炎症、纤维化和脂质代谢、储存和运输基因的能力。该药物曾于2019年2月获得美国FDA授予突破性疗法认定,用以治疗PBC。
2006年6月,CymaBay Therapeutics(曾用名Metabolex)与强生就代谢疾病药物签订全面开发和商业化协议,强生获得CymaBay包括seladelpar在内的3款药物的授权许可。2024年2月12日,吉利德宣布与CymaBay Therapeutics达成并购协议,吉利德将以每股32.5美元或总股本价值43亿美元的价格收购CymaBay,获得公司核心管线药物seladelpar。2024年2月12日,美国FDA接受seladelpar用于治疗PBC的新药申请(NDA),并授予其优先审评资格,PDUFA日期为2024年8月14日。
这次的加速批准主要基于关键安慰剂对照3期RESPONSE研究的数据。在该研究中,62%接受每日一次口服Livdelzi的受试者在第12个月达到了综合生化应答的主要终点,而此数值在安慰剂组中只有20%。使用Livdelzi治疗后,25%的患者在第12个月时ALP值恢复正常,而安慰剂组中的患者均未出现这种变化。ALP是一种胆汁淤积标志物,可预测肝移植和死亡的风险。第6个月时瘙痒评分相对于基线的变化是试验的关键次要终点。与安慰剂组相比,Livdelzi组患者的瘙痒症状显著减少。根据新闻稿,Livdelzi是在3期试验中,证明能够显著、持久改善瘙痒和胆汁淤积标志物的首个药物,这些标志物与疾病进展风险相关。
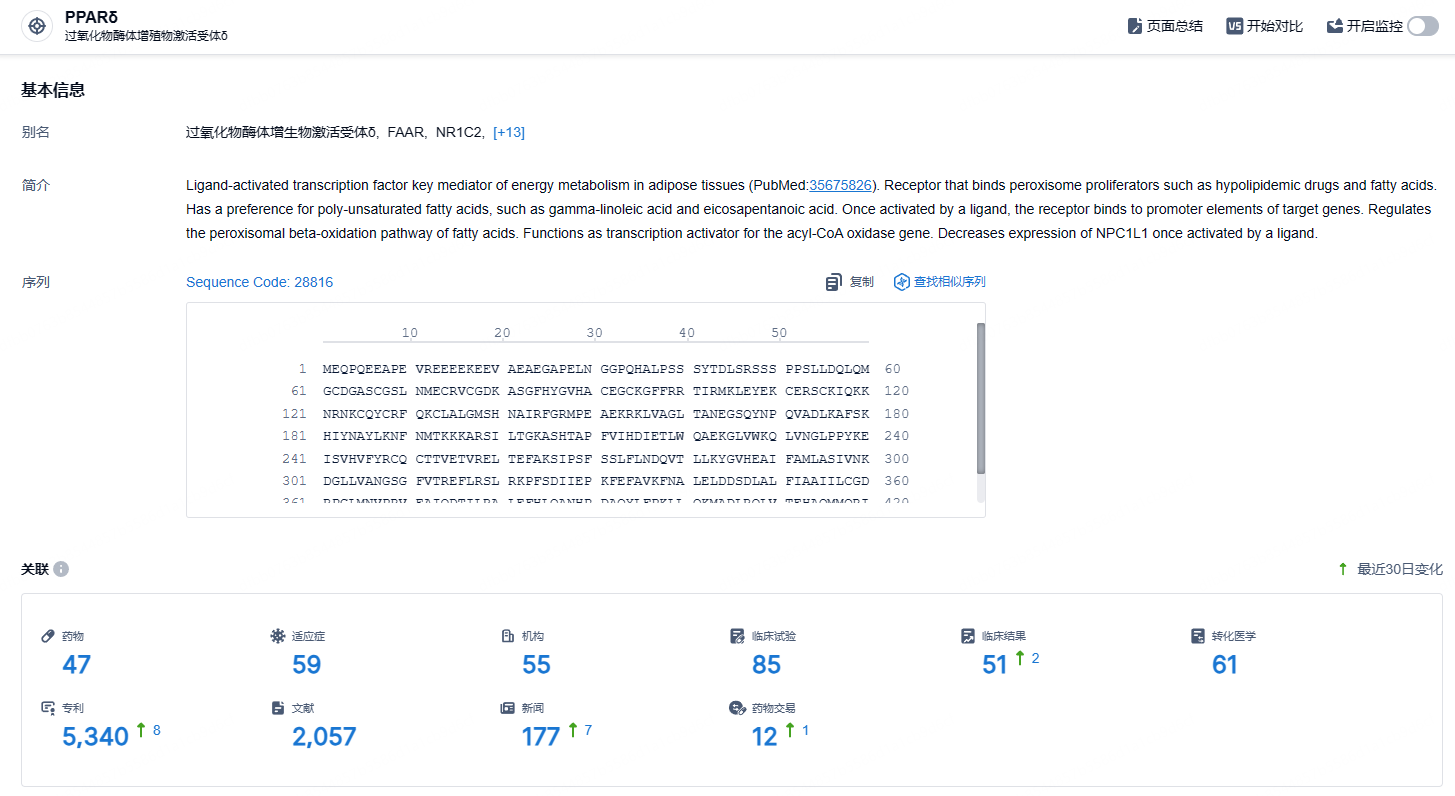
根据智慧芽新药情报库所披露的信息 (点击下方卡片直达 PPARδ 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到2024年8月16日,PPARδ靶点共有在研药物47个,包含的适应症有59种,在研机构55家,涉及相关的临床试验85件,专利多达5340件……PPARδ靶点其他pipeline几乎都因为不良反应问题阵亡,Seladelpar的开发历程漫长而曲折,开发公司从强生到CymaBay,适应症从糖尿病、血脂异常到NASH、PBC,期间已17载,虽然NASH适应症已基本宣告失败,但PBC市场仍有广阔空间,该药此次成功上市,为该靶点赛道带来新的曙光。