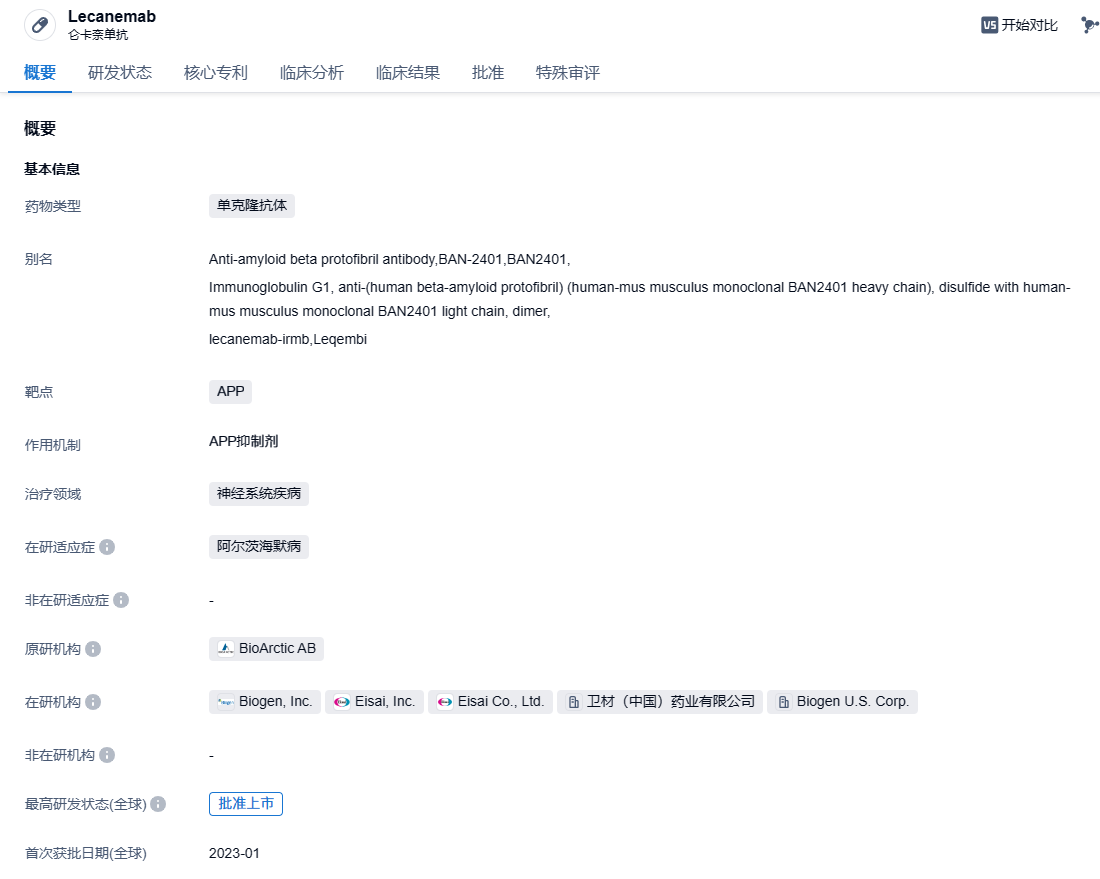
卫材仑卡奈单抗在日本成功获批,用于治疗阿尔茨海默病
2023年9 月 25 日,卫材宣布,仑卡奈单抗(Lecanemab)在日本获批上市,用于延缓阿尔茨海默病(AD)引起的轻度认知障碍(MCI)和轻度痴呆症的进展。卫材于 2023 年 1 月 16 日向日本药品和医疗器械管理局(PMDA)提交了仑卡奈单抗上市许可申请,于 1 月 30 日被纳入优先审评,并于近日获得批准。
仑卡奈单抗是一种抗β淀粉样蛋白(Aβ)单克隆抗体,能够选择性结合以中和消除可溶性、有毒的淀粉样蛋白-β (Aβ) 聚集体(原纤维),而这些聚集体被认为有助于AD中的神经退行性过程。它是卫材和BioArctic合作研发的成果,由卫材和渤健共同负责该产品用于AD治疗的开发和商业化。
2023年1月6日,基于IIb期概念验证性临床试验 (BAN2401-G000-201) 结果,FDA在加速审批途径下批准了仑卡奈单抗治疗AD的上市申请。不过,只有在轻度认知障碍或轻度痴呆阶段且在病理学上确认存在Aβ的AD患者中才能进行仑卡奈单抗治疗。在仑卡奈单抗获得加速批准的同一天,卫材向FDA提交了寻求仑卡奈单抗全面批准的sBLA(补充生物制品许可申请)。2023年7月6日,FDA官网显示卫材/渤健联合开发的仑卡奈单抗用于治疗阿尔茨海默症(AD)的加速批准已成功转为完全批准。这也意味着仑卡奈单抗成为了20年来首款获得FDA完全批准的AD新疗法。
仑卡奈单抗的完全批准是基于 Clarity AD III 期研究数据。仑卡奈单抗能选择性地结合并清除可溶的、具有神经毒性的 Aβ聚集体(原纤维)。因此,仑卡奈单抗将会对 AD 的病理生理学产生影响,并减缓疾病的进展。Clarity AD 研究显示,仑卡奈单抗的治疗达到了主要终点和所有关键的次要终点,结果具有显著统计学意义,且证实了仑卡奈单抗的临床获益。与安慰剂相比,在主要终点 CDR-SB 方面,仑卡奈单抗治疗 18 个月时显著降低 0.45分,降幅达到 27%。此外,由 AD 看护者评估的次要终点阿尔茨海默病协作研究组-轻度认知障碍-日常生活能力量表评分(ADCS-MCI-ADL)显示出 37% 的显著统计学获益。2022 年 11 月,Clarity AD 研究的结果在 2022 年阿尔茨海默病临床试验(CTAD)会议上公布,并同时发表在世界著名的同行评审医学杂志《新英格兰医学杂志》上。
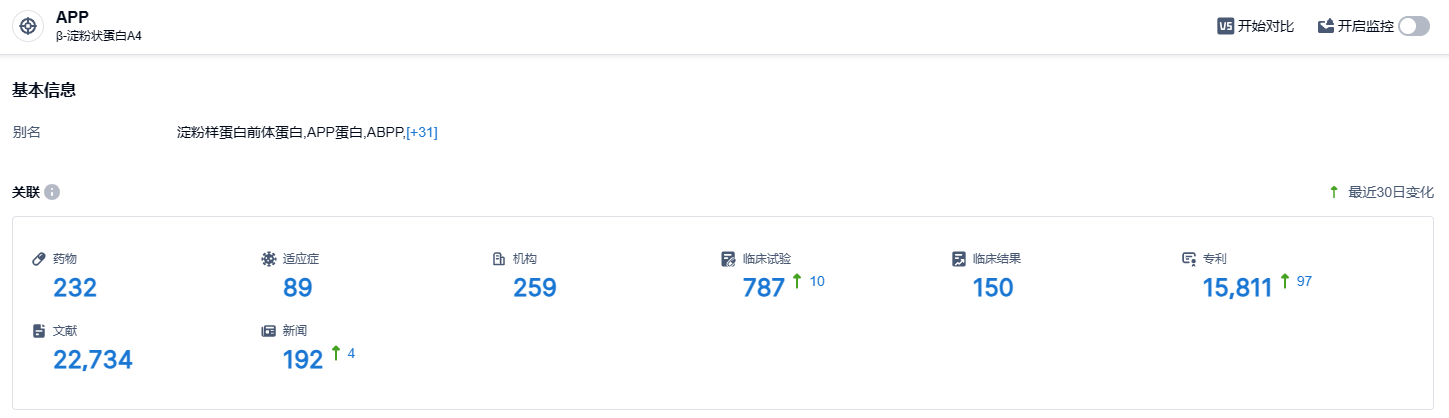
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 APP 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年7月9日,APP靶点共有在研药物227个,包含的适应症有86种,在研机构251家,涉及相关的临床试验763件,专利多达14030件……lecanemab此次在日本获批上市,给阿尔茨海默病新药开发增加了信心,期待该领域出现更加优效的新药。