罗氏KRAS G12C抑制剂divarasib 1期临床试验结果积极,持久产生临床缓解
日前,《新英格兰医学杂志》发布了由罗氏(Roche)旗下基因泰克(Genentech)公司所研发的KRAS G12C抑制剂divarasib(RG6330/GDC-6036)在携带KRAS G12C突变实体瘤患者中的1期试验结果。论文指出,divarasib可以在KRAS G12C阳性肿瘤中,产生持久的临床缓解。
divarasib(RG6330/GDC-6036)则是罗氏布局的一款新型 KRAS G12C 抑制剂 ,针对 KRAS G12C 突变 NSCLC 适应症已开发至 II/III 期临床阶段。在临床前模型中显示出对KRAS G12C蛋白具有有效的选择性抑制。该药物将突变的KRAS G12C锁定在失活状态,关闭致癌信号,从而达到抑制肿瘤生长的目的。它在体外的效果大约比目前已经被认可的KRAS G12C抑制剂Lumakras和Krazati在CRC中的效果高5~20倍,选择性大约在10~50倍和400毫克的剂量下药代动力学特征可以和西妥昔单抗相媲美,在试验中没有药物-药物相互作用。
这项1期试验的目的为评估携带KRAS G12C突变的晚期或转移性实体瘤患者,使用每日一次口服divarasib(剂量范围为50-400 mg)的作用。主要目的为评估药品的安全性,同时并检视其药代动力学特征、研究者评估的抗肿瘤活性以及显示病患缓解和耐药的生物标志物。该试验共招募了137位患者(包含60位NSCLC患者、55位结直肠癌患者、22位其他实体瘤病患)。分析显示,在NSCLC患者中,53.4%的患者观察到确认缓解(95% CI:39.9-66.7),中位无进展生存期为13.1个月(95% CI:8.8-无法估计)。在结直肠癌患者中,29.1%的患者观察到确认缓解(95% CI,17.6-42.9),中位无进展生存期为5.6个月(95% CI:4.1-8.2)。在其他实体瘤患者中也观察到缓解。循环肿瘤DNA的评估发现KRAS G12C变异等位基因频率下降,显示患者可能产生缓解。该研究亦识别出与divarasib耐药性相关的基因组变异。安全性方面,127例患者(93%)发生治疗相关不良事件;15例患者(11%)发生3级事件,1例患者(1%)发生4级事件。治疗相关不良事件导致19例患者(14%)药物减量和4例患者(3%)停止治疗。
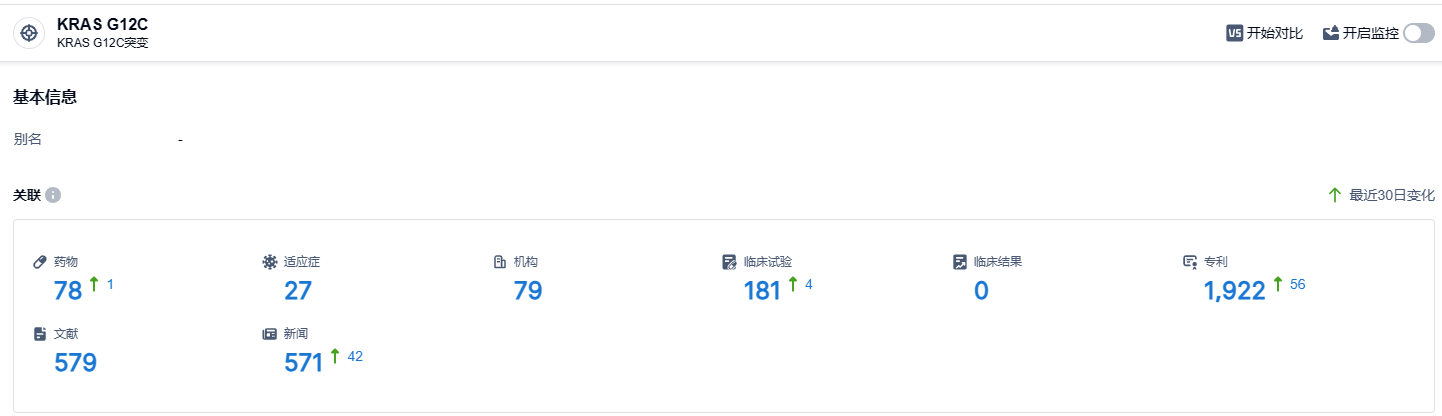
根据智慧芽新药情报库所披露的信息 (点击下方图片直达 KRAS G12C 靶点注册登录后可免费获得该靶点下的在研药物、适应症、研发机构、临床试验等详细信息),截止到 2023 年8月24日,KRAS G12C靶点共有在研药物78个,包含的适应症有27种,在研机构79家,涉及相关的临床试验181件,专利多达1922件……目前FDA已经批准了两款KRAS G12C抑制剂,国内外还有大量处于临床阶段的KRAS G12C抑制剂。KRAS G12C,曾经被认为是“不可成药”,现在已经成为“可成药”最热门的靶标之一。