预约演示
Pharmaceutical Insights
通过我们对新药、药物靶点、生物序列、小分子结构、机构研发管线和临床进展的洞察,探索生物医药行业的趋势。

最新博客
功能更新
阅读时长 5分钟
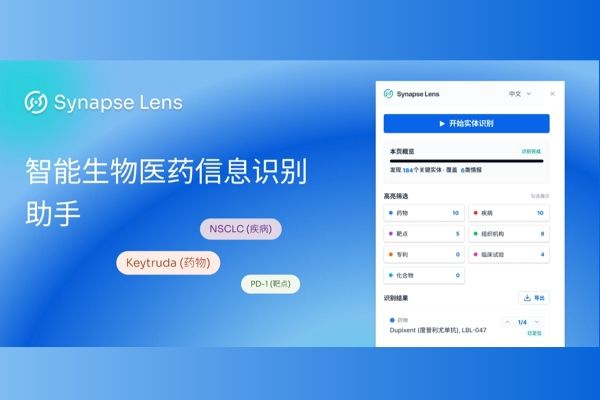
Synapse Lens,一款专为生物医药从业者打造的智能信息识别助手(内含安装手册)
2026-02-03
在生物医药行业,海量的信息流既是机会也是挑战。面对PubMed文献、FiercePharma行业资讯和各大药企官网,如何从碎片化的文本中快速提取核心情报?今天为您隆重推荐——Synapse Lens,一款专为生物医药从业者打造的Chrome插件,能力由智慧芽新药情报库提供支持。它将成为您的“资讯阅读加速器”,一键将普通网页转化为结构化情报。
最新资讯
阅读时长 5分钟
靖因药业:全球首例siRNA降脂药物进入高血脂II期临床试验
2026-01-04
12月31日,靖因药业宣布,其siRNA新药SRSD216在关于治疗高脂蛋白血症的2期临床试验中,首例患者已经成功完成用药。此次临床试验在中国和美国同步进行,采用随机、双盲、安慰剂对照设计,计划招募大约60名受试者,要求其脂蛋白(a)水平高于150 nmol/L。参加者将被随机分配到三个不同剂量组:100毫克、300毫克和600毫克。
最新资讯
阅读时长 4分钟
葛兰素史克公布Arexvy疫苗积极数据,覆盖三季节有效防护RSV
2026-01-04
葛兰素史克(GSK)近日宣布了AReSVi-006 III期临床研究的重要成果。该研究的目的是评估其研发的RSV疫苗Arexvy在连续三个呼吸道合胞病毒(RSV)流行季节中的保护效力及安全性。特别针对60岁及以上的成年人群,包括高风险群体,Arexvy展现出了非凡的保护效果。研究结果将在2024年美国胸科医师学会年会上进行详细介绍。
A
最新资讯
阅读时长 3分钟
英百瑞ACC-NK(IBR854)第二项II期临床试验正式获得国家药监局受理
2026-01-04
2025年12月30日,英百瑞的核心产品ACC-NK(IBR854)迎来了重要的进展。其IBR854细胞注射液联合化疗方案(培美曲塞和顺铂)作为一线治疗方案,已用于治疗局部晚期或转移性的非鳞状非小细胞肺癌,并获得国家药监局药品审评中心的II期临床试验申请受理(受理号:CXSL2501161、CXSL2501162)。这一成就巩固了英百瑞在
最新资讯
阅读时长 5分钟
智翔金泰BCMA×CD3双抗「GR1803注射液」入选优先审评名单
2026-01-04
国家药品监督管理局药品审评中心(CDE)官网近日公布的信息显示,由智翔金泰自主研发的BCMA×CD3双特异性抗体药物「GR1803注射液」拟被纳入优先审评。这一决定旨在加快其上市速度,帮助复发或难治性多发性骨髓瘤患者获得新的治疗选择。该疾病患者需要至少接受三线治疗,包括蛋白酶体抑制剂、免疫调节剂和CD38抗体。
多发性骨髓瘤是血液系统中
最新资讯
阅读时长 3分钟
前沿生物FB7013注射液临床试验申请获批,MASP-2靶向创新引发广泛关注
2026-01-04
2025年12月31日,前沿生物药业(南京)股份有限公司发布公告,宣布其自主研发的siRNA药物FB7013注射液的临床试验申请已经国家药品监督管理局受理。该药物以MASP-2蛋白为靶点,面向治疗原发性免疫球蛋白A肾病(IgA肾病),在全球范围内首次提出临床试验申请,展现出成为同类首创(First-in-Class)药物的潜力。
公告透
最新资讯
阅读时长 6分钟
全球首款双靶点CAR-T疗法震撼亮相,胃癌与胰腺癌治疗迎来新突破
2026-01-04
CAR-T疗法在血液肿瘤中的成功,为我们展现了其在癌症治疗上的巨大潜力。然而,当挑战转向90%癌症类型的实体瘤时,这一疗法的成效却曾显得乏力。然而,全球医学研究者的不断努力,使这场持久的攻坚战开始出现曙光。
在刚刚结束的2025年欧洲肿瘤内科学会年会上,一项引人注目的突破由中国研究团队带来,他们的新型CAR-T细胞疗法针对晚期胃癌和胰腺
最新资讯
阅读时长 3分钟
全国首例TIL疗法成功治愈KRAS突变患者,18周无癌生存!
2026-01-04
继CAR-T疗法引发热议之后,一种面向实体瘤的新型细胞疗法——肿瘤浸润淋巴细胞(TIL)疗法,已经吸引了全球医学界的目光。TIL被誉为肿瘤细胞的“天然克星”,因其基于自体肿瘤浸润淋巴细胞开发,从而具备了丰富的肿瘤特异性靶点和良好的安全性。
近期,我国传来了一则振奋人心的消息:KRAS突变阳性肺癌患者在接受GC101 TIL疗法后,病灶完
最新资讯
阅读时长 4分钟
中国生物制药突破全球首例:类癌症肺病治疗迎新曙光,国产创新药全球领先
2026-01-04
2025年12月31日,中国医药界传来了令人振奋的新闻。中国生物制药公司正式宣布,其自主研发的ROCK2抑制剂TDI01已在治疗特发性肺纤维化(IPF)的Ⅲ期临床试验中成功完成首例患者入组。这一成就标志着TDI01成为全球首个进入IPFⅢ期临床阶段的高选择性ROCK2抑制剂,宣告中国在纤维化疾病创新药物领域,已从“追随者”跃升为“全球领跑
最新资讯
阅读时长 4分钟
2026超长效银屑病创新药ORKA-001重磅登场,临床试验展现突破性治疗潜力
2026-01-04
2026年,银屑病治疗领域迎来了重大革新,一款名为ORKA-001的全新长效药物问世。该药物以其仅需每年皮下注射一次的显著优势,成功解决了银屑病患者过去频繁用药的痛点,为全国超过700万名银屑病患者,尤其是中重度斑块状银屑病患者,提供了一种更加轻松和便捷的治疗选择。
ORKA-001作为一种靶向IL-23p19的最新长效单克隆抗体,代表
最新资讯
阅读时长 5分钟
默沙东诺奖突破助推抗癌新药有望获中国优先审评
2026-01-01
近日,中国国家药监局药品审评中心(CDE)在官方网站上发布公示,默沙东公司(MSD)申请的贝组替凡片被建议纳入优先审评程序。贝组替凡片是一种口服低氧诱导因子2α(HIF-2α)抑制剂,此次申请的适应症为成人及12岁及以上青少年患者中治疗局部晚期、不可切除或转移性的嗜铬细胞瘤或副神经节瘤(PPGL)。今年5月,该药物已获美国FDA批准用于相
最新资讯
阅读时长 5分钟
靖因药业SRSD216治疗高脂蛋白(a)血症II期临床试验首例患者完成给药
2026-01-01
2025年12月31日,靖因药业,一个专注于小干扰RNA (siRNA) 疗法开发的临床阶段生物技术公司,欣然宣布其用于治疗高脂蛋白(a)血症的新型siRNA药物SRSD216在二期临床试验中成功完成了首例患者给药。这一重要的里程碑,标志着靖因药业在努力满足脂蛋白(a)升高患者迫切医疗需求的道路上又向前迈出了重要一步。公司的首席医疗官于沛