预约演示
肿瘤治疗:抗体药物的研究设计思路
抗体临床研究
2023年2月20日,来自悉尼加文医学研究所的Daniel Christ教授等在Nature Cancer上发表了题为Advances in antibody-based therapy in oncology的综述,概述了领域的主要进展,特别关注于最近和新兴的工程抗体候选物,讨论其分子结构和作用机制,为临床开发和实践提供信息。
人类抗体的分子特性

Preview
来源: 行舟Drug
人类抗体分子有五种不同的同种型,分别为IgG、IgA、IgM、IgD和IgE。其中,人类IgG同型和相关的抗体片段最常用于治疗目的。人类IgG分子约为150 kDa,由两条重链和两条轻链组成,通过二硫键连接(图1)。单克隆抗体表现出相对缓慢的组织渗透性和较长的血清半衰期。优化单克隆抗体药物的分子工程包括旨在延长其血清半衰期,增强靶亲和力,增强效应功能,降低免疫原性和改善其可发展性的策略(图1b)。
作用机理
单克隆抗体能够通过一系列的机制来执行其治疗作用,这些机制包括从简单的阻断到激活和增强我们的自然免疫反应。
受体和配体阻断
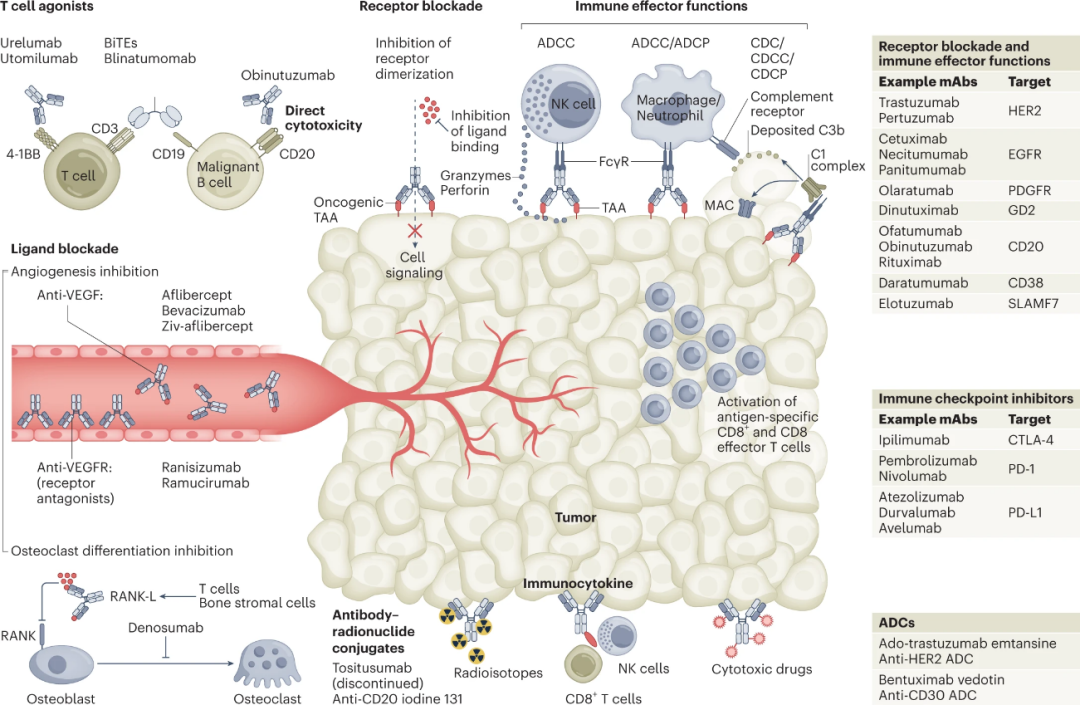
Preview
来源: 行舟Drug
由于其高亲和力和特异性,单克隆抗体可以与特定的细胞群相互作用,从而能够干扰对肿瘤存活和增值至关重要的受体。这种作用模式在一定程度上与表皮生长因子受体(EGFR)/人上皮生长因子受体(HER)1、HER2、HER3和HER4的受体酪氨酸激酶相互作用的曲妥珠单抗(Herceptin)和西妥昔单抗(Erbitux)的活性有关。相反,配体阻断是贝伐珠单抗(Avastin)的主要作用机制,它能阻止血管内皮生长因子(VEGF)与其同源受体(VEGFR1和VEGFR2)的结合,抑制血管生成和新血管的形成(图2)。抗体可以竞争性地与这些受体和配体结合,从而阻断配体与受体的相互作用和下调信号传导,也可以抑制受体的多聚化。
直接细胞毒性
介导靶癌细胞的直接细胞毒性的另一类治疗性单克隆抗体是那些设计用于激活死亡受体的抗体。例如,肿瘤坏死因子(TNF)相关凋亡诱导配体的受体DR4和DR5被单抗作为靶点,再现其凋亡诱导作用,导致Fas相关蛋白的募集,随后形成死亡诱导信号复合物,启动依赖caspase的凋亡性细胞死亡。目前该类药物处于临床开发阶段。
免疫效应器功能
免疫检查点阻断
细胞毒性T淋巴细胞相关蛋白4(CTLA-4)是一种免疫检查点分子,在细胞毒性T淋巴细胞上高度表达。CTLA-4通过一系列受体-配体的相互作用和对B7配体的高亲和力,从而阻断刺激性信号和下调T细胞活性,推动免疫抑制和肿瘤逃避免疫监视,CTLA-4与共受体CD28有竞争性拮抗作用。Ipilimumab是一种针对CTLA-A的高亲和力的人类单克隆抗体。PD-1及PD-L也是单克隆抗体靶点,其他的免疫检查点也是备受关注的焦点,包括淋巴细胞激活基因-3(LAG-3)、T细胞免疫球蛋白及粘蛋白结构域分子3(TIM-3)以及T细胞免疫球蛋白和ITIM结构域(TIGIT)。将新的免疫检查点抑制剂的临床前结果转化为临床的具有挑战,所以需要建立临床前模型,更准确地确定其与该领域成熟药物的协同效应。
免疫受体激动剂
通过免疫检查点阻断诱导T细胞激活以促进抗肿瘤反应的一种相反的方法是使用激动性抗体。从蛋白质工程的角度来看,与开发阻断性抗体相比,确定能够触发激动性信号的单克隆抗体需要额外的考虑。应谨慎管理诱导明显的免疫细胞激活导致严重的毒性的风险,以避免严重的不良事件。目前正在临床开发的单克隆激动剂抗体包括针对41BB、OX40、GITR、ICOS和CD27的药物。激动性抗体的活性可以通过在FcγR阳性细胞表面的Fc交联来增强,特别是通过表达高水平抑制性受体FcγRIIb的B细胞。因此,开发以Fc交联为条件诱导T细胞激活的较弱的激动剂,可能会导致T细胞激动剂的安全性提高。除了T细胞激活,免疫受体激动剂单克隆抗体的一个意想不到的作用机制是,由于调节性T(Treg)细胞表面的共刺激受体水平增加,导致调节性T(Treg)细胞的渗入和耗竭,从而使抗肿瘤反应得到增强。这种双重作用机制在评估靶向GITR、OX40和ICOS(以及CTLA-4)的单克隆抗体活性的临床前研究中已被广泛报道。
抗体-药物结合物
这类疗法结合了抗体的靶向能力和小分子的抗肿瘤活性。目前,有13种ADCs被批准用于治疗实体瘤和恶性肿瘤。ADCs由一个靶向肿瘤抗原的抗体和一个将抗肿瘤药物(有效载荷)连接到抗体上的连接体组成。为了引起细胞毒性,ADC与癌细胞表面的靶点结合,被内化并进入溶酶体,在那里连接体或抗体的裂解和/或蛋白分解导致有毒载荷的释放。ADC靶点对于治疗实体肿瘤和血液系统恶性肿瘤来说是不同的,在实体瘤中,抗体靶点的选择主要集中在过表达的表面蛋白上,这些蛋白能够通过快速内化将ADC运送到癌细胞中。在恶性血液病中,细胞系限制性靶点的存在提供了降低健康上皮组织毒性的优势。识别成功的ADC靶点一般侧重于肿瘤和健康组织之间mRNA的差异表达;然而,人们越来越重视通过蛋白质组学方法识别可能代表靶点的细胞表面抗原,这种方法有可能发现具有重要功能的靶点。
许多ADCs也正在评估与癌症治疗药物的组合,这些治疗药物的作用机制与有效载荷的作用机制互补。了解特定有效载荷的作用机制,同时确定敏感性和耐药性的生物标志物,可能有助于确定提高治疗指数和/或克服耐药性的合理组合。
抗体片段、双特异性T细胞衔接器和TCR模拟物
抗体片段与全长IgG抗体的不同之处在于它们的尺寸减小,血清半衰期缩短,同时保留了大部分的特异性结合特性。因此,它们很适合于介导短期的药理作用,特别是对于治疗窗口小、不良事件风险高的适应症或靶点。
按照这一逻辑,抗体片段的主要是作为细胞毒性或放射性药物的载体,以及在双特异性T细胞衔接器(BiTEs)中的应用。BiTEs是T细胞和癌症靶细胞之间相互作用的桥梁,它通过针对T细胞受体复合体(CD3ε)的激发型抗体片段与T细胞结合,通过第二个基因融合的抗体片段与肿瘤抗原结合,从而形成一个人工免疫突触,促进T细胞介导的对靶细胞的杀伤(图2)。由于T细胞激活可导致治疗相关的不良事件发生,包括细胞因子释放综合症和神经系统毒性。BiTEs的半衰期短,有助于此类不良事件的处理;然而其较短的血清半衰期也会导致繁重的管理,患者往往需要长期持续输液。随着新一代药物进入临床,仔细处理不良事件将是至关重要的。尽管有这些挑战,但大量的BiTE候选物具有相当大的治疗前景。
放射免疫偶联药物
放射免疫偶联药物(RICs)是一类新兴的癌症靶向治疗,区别于传统的外部放射治疗,RICs采用靶向剂来进行治疗性放射的系统传递。与ADC类似,靶向剂可以是完整的抗体或衍生物(例如Fabs、scFvs和minibody)、肽或小分子配体。与ADC不同,RICs中通过一种螯合剂而不是连接体来非共价地捕获放射性核素,螯合剂和放射性核素共同构成了治疗的有效载荷。
治疗性RICs主要采用两类放射性核素:α-粒子和β-粒子发射体,后者在较长的范围内提供低能量,而前者则在短距离内集中高能量。它们不同的特性为α和β发射的RIC的有效性和安全性提供了不同的优势和劣势。与ADC一样,放射性有效载荷的选择可能最好考虑几个因素,包括目标抗原概况、肿瘤微环境和肿瘤生物学。
糖基化抗体、细胞因子武装抗体和可活化的抗体
Preview
来源: 行舟Drug
尽管天然人IgG单克隆抗体改变了肿瘤治疗方式,但改变抗体的结构可以扩大临床应用范围。这种工程变化中最常见的是调节Fc区的糖基化模式(图1b)。除了糖基化的变化,通过Fc区的点突变来调节抗体效应功能的蛋白质工程方法也已被报道。这种方法产生了特定的变体,其ADCC、CDC或FcRn结合性增加或减少,从而影响了药代动力学。
替代形式
除了IgG单克隆抗体外,在开发用于治疗的非IgG同种型方面也取得了进展。尽管非IgG抗体在某些应用中很有前景,但其临床和商业上的成功可能需要工程设计或确定特定的适应症,在这些适应症中可以证明比IgG类抗体有明显的优势。
最近一项旨在扩大基于抗体疗法的治疗窗口的策略是可激活抗体的工程。蛋白酶的激活是许多蛋白酶、细胞因子和生长因子家族生物合成的一个关键特征;它们的每个成员首先以非活性或活性降低的原形表达,随后通过蛋白酶裂解将成熟的蛋白质从前体多肽中分离出来,从而激活。根据这一观察,已经研究了为单抗产生帽或掩蔽域的工程方法。
结论
原文链接:https://doi.org/10.1038/s43018-023-00516-z
内容来源于网络,如有侵权,请联系删除。
机构
-靶点
生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


