预约演示
最新速递!双抗治疗癌症的现状和未来
抗体药物偶联物临床研究
■ 双抗 (bsAb) 可使用新作用机制进行治疗和应用,而传统 IgG 抗体无法实现。因此在过去十年中,双抗的开发引起了研究人员的极大兴趣,截至 2023 年底,已有 14 种双抗成功获批:11 种用于治疗癌症,3种用于非肿瘤适应症。
■ 本文概述了用于治疗癌症的双抗领域的最新进展,专注于已获批或处于临床开发中的双抗,包括双抗介导的信号通路双重调节剂、肿瘤靶向受体激动剂、双抗-药物偶联物、双特异性 T 细胞、自然杀伤细胞和先天免疫细胞接合剂以及双特异性检查点抑制剂和共刺激器。
现状简介 Bispecific antibodies
双特异性抗体(bsAb,bispecific antibodies)是一种通过基因重组、化学偶联或四重杂交瘤的方式构建的、包含两个靶向结合单元的抗体分子,其中每个单元均可独立识别特异性表位,bsAb在体内可以通过不同作用模式(MoA,mechanism of action),以组合或专性方式发挥作用,能够介导超越天然单抗的治疗效果,例如通过向癌细胞招募免疫效应细胞或用单个分子靶向不同的信号传导途径。
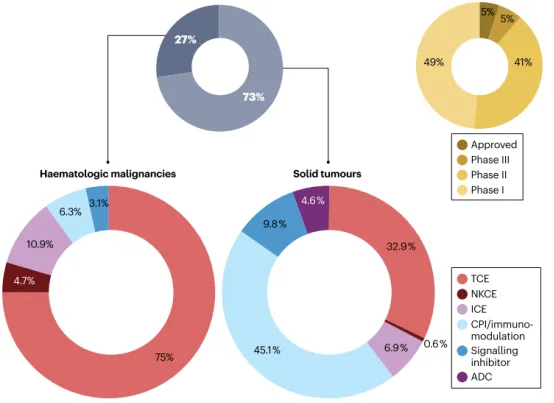
靶标选择、表位位置、亲和力、化合价、结合位点之间的距离、分子大小、灵活性、是否存在 Fc 区以及 Fc 介导的效应器功能等特性都是可开发性的重要影响因素。越来越多的癌症治疗方法正在开发中(图 1)。根据癌症类型、临床阶段和作用方式进行分组,临床开发中50% 的双抗处于 II 期和 III 期或已获批。
大约75%的 bsAb 被开发用于治疗实体瘤,实体瘤的治疗主要以 T 细胞接合剂 (TCE;32.9%) 和具有检查点抑制和/或免疫调节作用机制的 bsAb (45.1%) 为主。
大约25%用于治疗血液恶性肿瘤,主要是TCE(75%)和其他 MoA(21.9%),涉及免疫活性,例如由于可用性而通过检查点抑制和/或免疫调节来参与自然杀伤细胞和其他免疫细胞高度肿瘤选择性或谱系特异性抗原。大约 10% 的用于治疗实体瘤的双抗使用了双重信号抑制。迄今为止,bsAb 抗体-药物偶联物 (ADC) 已被开发用于治疗实体瘤。
Preview
来源: BiG生物创新社
CPI,检查点抑制剂;ICE,先天免疫细胞接合器;NKCE,自然杀伤细胞接合器。
对 ClinicalTrials.gov、Cortellis 和抗体协会提供的数据进行的搜索显示,有超过 300 项临床试验涉及 200 多种不同的双特异性分子,其中大约 75% 用于治疗实体瘤,(图 1)。前有10种双抗药物被获批用于癌症治疗,其中9种在美国和欧洲获批,卡多利单抗在中国获批。在这 10 种双抗中,有 9 种可归类为 TCE。卡妥索单抗是第一个获批的双抗,于 2013 年撤回市场(表 1 和图 2)。
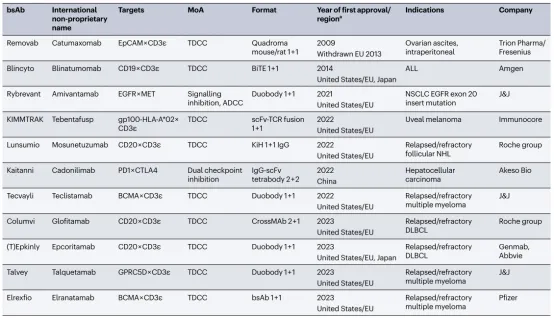
表 1 | 获批用于癌症治疗的双抗
Preview
来源: BiG生物创新社
BiTE,双特异性 T 细胞接合器;bsAb,双抗;DLBCL,弥漫性大B细胞淋巴瘤;EGFR,表皮生长因子受体;EpCAM,上皮细胞粘附分子;GPRC5D,C类G蛋白偶联受体5组成员D;
MoA,作用机制;NSCLC,非小细胞肺癌;NHL,非霍奇金淋巴瘤;scFv,单链可变片段;
TCR,T细胞受体;TDCC,T 细胞依赖性细胞毒性。获批地区仅限于美国、欧盟 (EU)、日本和中国;产品也可能在其他国家获批,截至 2023 年底。
用于双受体抑制的双抗 Bispecific antibodies
与疾病相关的表型经常由不止一种途径触发,允许细胞通过使用其他补偿性信号传导途径,通过单一靶标或途径克服药理生长抑制或诱导细胞毒性。同时调节不同疾病相关信号受体和/或途径的双抗可以减少或克服这一限制。
阿米万他单抗 (JNJ-61186372) 靶向 EGFR 和肝细胞生长因子受体 (MET),这两种受体都会触发非小细胞肺癌 (NSCLC) 的增殖,因此,阻断这两种受体可以比仅阻断一种途径更有效地抑制 NSCLC 生长。
用于配体受体抑制的双抗 Bispecific antibodies
可以通过干扰受体二聚化或络合,或通过阻断受体的配体结合位点来抑制受体激活。在癌症中,来自多个互补或代偿途径的配体和受体通常会导致肿瘤进展和治疗耐药。双抗可以同时阻断两种不同的配体,无论是可溶性的还是细胞膜附着的,或者是配体和受体的组合。
用于受体激活的双抗 Bispecific antibodies
许多抗肿瘤反应是通过激活细胞表面受体介导的,包括免疫反应或通过诱导细胞凋亡导致的细胞死亡。癌症治疗的一种方法是靶向递送受体激活配体,如生长因子、细胞因子和(共)免疫刺激配体,通过将它们融合到抗体或抗体片段上,诱导局部或组织特异性激动活性,从而产生细胞反应。越来越多的抗体-配体融合蛋白正在进入临床试验阶段。
用于靶向 有效负载递送的双抗 Bispecific antibodies
有两种方法使用双抗来靶向递送有效负载(例如细胞毒性剂或放射性)。第一种方法是预靶向治疗,利用双抗的一种结合特异性来靶向肿瘤细胞,另一种结合特异性随后捕获肿瘤上的有效负载。有一种新的自组装双特异性预靶向概念,称为 SADA,使用修饰的 p53 四聚化结构域来延长 GD2 × DOTA 的肿瘤保留。双抗GD2 x DOTA可识别 GD2(一种在癌症中高表达的二唾液酸神经节苷脂)和放射性有效负载 177 Lu-DOTA ,在 TME 中组装并保留,但如果没有四聚化,缺乏半衰期延长,它会迅速从外围清除。到目前为止,临床试验中很少有双抗使用这种 MoA,这可能是由于放射性预先靶向所涉及的复杂后勤工作,不具普遍适用性。
Preview
来源: BiG生物创新社
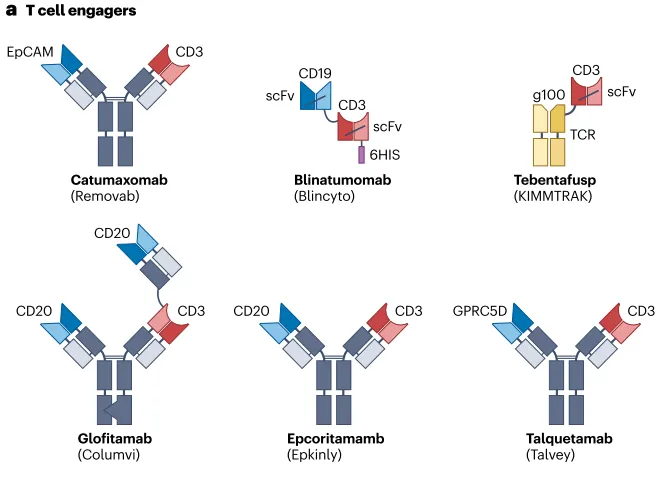
图2| 已获批用于癌症治疗的双抗概述。a,双特异性 T 细胞接合器 (TCE)。b,其他双抗 (bsAb)(非 T 细胞接合剂)。11 种获批的 bsAb 中的 6 种具有 IgG 样结构,由 2 条重链(以深灰色显示的恒定区和以深蓝色或深红色显示的 Vh 结构域)和 2 条轻链(以浅灰色显示的恒定区和以深蓝色或深红色显示的 Vl 结构域)组成)。BCMA,B细胞成熟抗原;EGFR,表皮生长因子受体;EpCAM,上皮细胞粘附分子;GPRC5D,C 类 G 蛋白偶联受体第5成员D。
目前临床开发中很大一部分双抗已处于后期阶段(II 期和 III 期)。治疗实体瘤的bsAb以免疫调节剂为主,包括双CPI(约45%)和TCE(约33%),其次是针对双通路、ICE和双ADC的bsAb。相比之下,TCE 是用于治疗血液恶性肿瘤的主要 bsAb 类别(约 75%),其次是 ICE、双重 CPI 和 NKCE(图 3)。
Preview
来源: BiG生物创新社
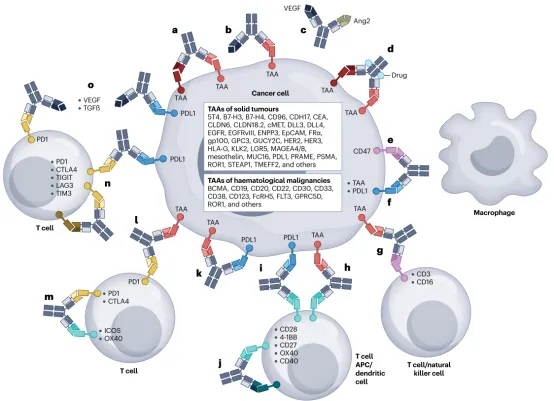
图3| 目前在临床试验中的双特异性抗体的作用方式。a,通过受体阻断两种不同信号受体(用不同颜色表示)来抑制信号。b,通过抑制可溶性配体(蓝色)和受体来抑制信号。c,通过两种不同配体的双重阻断来抑制信号。d,通过双抗 (bsAb) 药物缀合物进行药物输送(缀合物以浅蓝色表示)。e,有针对性地阻断“别吃我”信号(CD47-SIRPα相互作用),导致巨噬细胞吞噬。f,封锁“不要吃我信号”与检查点抑制相结合。g,效应细胞通过作为 T 细胞上 T 细胞受体 (TCR) 一部分的 CD3 或自然杀伤细胞上 CD16 (FcγRIIIa) 的参与。h,肿瘤细胞结合介导的免疫细胞(共)刺激。i,PDL1 结合介导的免疫细胞(共)刺激。j、双重免疫细胞共刺激。k,肿瘤靶向 PDL1 通路抑制。l,肿瘤靶向PD1通路抑制。m,检查点结合介导的免疫细胞(共)刺激。n,双重检查点抑制。o,通过配体阻断实现双重检查点和可溶性转化生长因子-β (TGFβ) 信号传导抑制。展示了实体瘤和血液恶性肿瘤的靶分子和肿瘤相关抗原 (TAA) 的示例。注意:bsAb 可以同时发挥多种作用模式 (MoA)。
用于癌症免疫治疗的双抗 Bispecific antibodies
癌症免疫治疗中使用的大多数双抗或是通过 T 细胞驱动的天然或内源免疫发挥作用,例如通过增强预先存在的抗肿瘤反应和/或克服检查点抑制,或是通过双抗驱动参与、激活等提供合成免疫或通过提供合成免疫,例如通过bsabb驱动的免疫细胞的参与、激活和募集(图3)。本文概述了 bsAb 和多特异性抗体的最重要的 MoA,包括 CPI、效应细胞接合器(包括 TCE 和 ICE)以及共刺激 bsAb。
表 2 | 后期临床开发中选定的双抗概述
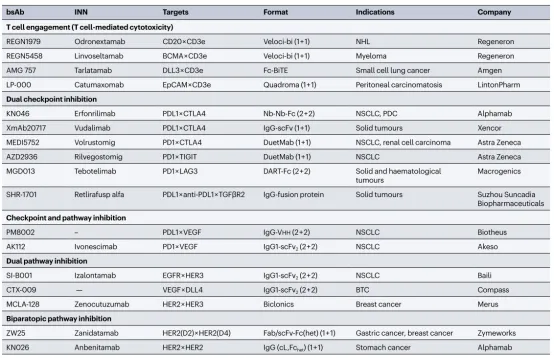
Preview
来源: BiG生物创新社
双 CPI Bispecific antibodies
许多干扰免疫检查点的单特异性抗体(例如 CTLA4 或 PD1/PDL1)被获批用于癌症免疫治疗,包括 ipilimumab、tremelimumab、nivolumab、pembrolizumab、atezolizumab、avelumab、durvalumab 或cemiplimab59。
效应细胞接合器<br>
T 细胞接合器 Bispecific antibodies
在过去的二十年中,特异性结合肿瘤表面抗原和 TCR 的 CD3ε 链的 TCE 在此类 bsAb 中占据主导地位。第一个获批上市的bsAb是小鼠/大鼠嵌合上皮细胞粘附分子(EpCAM)×CD3ε bsAb catumaxomab101,该药物于2009年在欧盟(EU)获批用于腹腔内治疗恶性卵巢腹水,但随后被撤回。目前中国正在再次进行腹腔给药临床试验评估。
固有细胞接合器 Bispecific antibodies
尽管 TCE 在效应细胞接合器领域占据主导地位,但仍在大力开发下一代 ICE,其中包括 NKCE 和 bsAb,可接合骨髓源性细胞 (MDC) 进行吞噬作用,包括中性粒细胞和巨噬细胞/单核细胞。与传统单克隆抗体相比,几种具有增强 ADCC 功能的 Fc 工程化 IgG1 抗体已获批,包括 obinutuzumab、mogamulizumab、tafasitamab、margetuximab 和 amivantamab190。
为了进一步增强 ADCC 功能,使其超越 Fc 工程 IgG1 抗体的功能,针对自然杀伤细胞上不同表面分子(例如 CD16、NKG2D、NKp46 或 NKp30)的各种双特异性 NKCE191 已被开发为免疫疗法。这些 NKCE 中最先进的是用于治疗霍奇金淋巴瘤的短半衰期 CD30 × CD16 双特异性 bsAb,可用作单一疗法、与检查点抑制相结合或与自然杀伤细胞输注相结合。
新兴概念 Bispecific antibodies
bsAbs领域仍在不断进步,以进一步探索和扩展技术和应用。学术界、生物技术和制药行业所追求的各种早期探索性双抗方法都是有前景的。
a,三特异性 T 细胞接合器 (TCE),具有集成共刺激,通过 CD3 结合同时激活 T 细胞受体 (TCR)(信号 1),并通过与 CD28 结合进行共刺激(信号 2)。
b,双抗(bsAb)前药的作用模式。灭活抗体以产生前药并重新激活位于所需作用位点的前药的一般概念包括封锁结合位点以灭活和蛋白酶诱导的被封锁抗原结合位点的激活、响应于目标环境(例如酸性 pH 或 ATP)的亲和力调节以及组装 或由于补充前药通过高局部浓度局部富集而引起的交换反应。
c,蛋白水解靶向嵌合体 (PROTAC) 方法通过与表面抗原(肿瘤相关抗原 (TAA))和降解剂部分(例如膜 E3 连接酶)结合,导致细胞表面靶标的内化和蛋白酶体降解。
d,bsAb 递送(例如通过基因疗法)至 CAR-T 细胞中。
e,细胞因子模拟bsAb通过将受体结构域引入空间附近来触发细胞因子受体途径,<br>
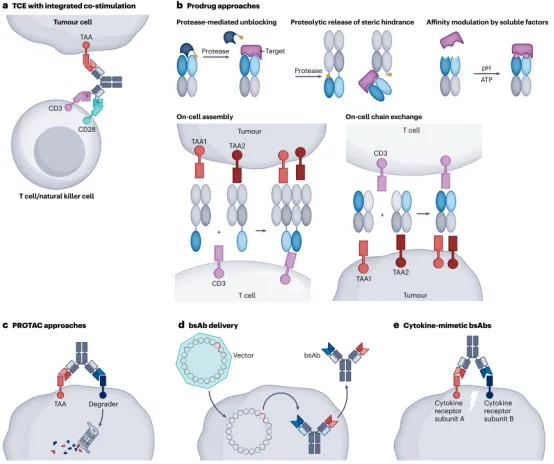
Preview
来源: BiG生物创新社
|展望|
bsAb 领域最近取得了实质性进展,到 2023 年底,已有十多种 bsAb 获批,许多不同的方法正在临床中进行测试。抗体需要针对某些应用进行定制,并且将依赖与其他方法的组合来最大化其功效和安全窗口。在不久的将来,具有多种特异性的抗体疗法的开发可能会出现在以下四个领域:
①针对具有明确依赖性的肿瘤的肿瘤相关 RTK 的 bsAb;
②bsADC 用于以更高的选择性靶向肿瘤;
③用于靶向降解适用于各种途径的细胞表面蛋白的双特异性 PROTAC;
④以及用于癌症免疫治疗的多特异性抗体,如T细胞疗法,TCE或CAR-T 。
与其他癌症药物一样,通过改进诊断方法和新开发模式,将bsab和基于多特异性抗体的疗法应用于疾病早期的患者,对于实现治愈癌症患者的目标至关重要。
参考文献:
Brinkmann, U. & Kontermann, R. E. Bispecific antibodies. Science 372, 916–917 (2021).
Weber, F. et al. Brain shuttle antibody for Alzheimer’s disease with attenuated peripheral effector function due to an inverted binding mode. Cell Rep. 22, 149–162 (2018).
Zhao, P., Zhang, N. & An, Z. Engineering antibody and protein therapeutics to cross the blood–brain barrier. Antib. Ther. 5, 311–331 (2022).
Galvez-Cancino, F. et al. Fcγ receptors and immunomodulatory antibodies in cancer. Nat. Rev. Cancer 24, 51–71 (2024).
Pyzik, M., Kozicky, L. K., Gandhi, A. K. & Blumberg, R. S. The therapeutic age of the neonatal Fc receptor. Nat. Rev. Immunol. 23, 415–432 (2023).
内容来源于网络,如有侵权,请联系删除。<br>
机构
-生物医药百科问答
全新生物医药AI Agent 覆盖科研全链路,让突破性发现快人一步
立即开始免费试用!
智慧芽新药情报库是智慧芽专为生命科学人士构建的基于AI的创新药情报平台,助您全方位提升您的研发与决策效率。
立即开始数据试用!
智慧芽新药库数据也通过智慧芽数据服务平台,以API或者数据包形式对外开放,助您更加充分利用智慧芽新药情报信息。


